
| A、n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1 |
| B、容器内压强保持不变 |
| C、H2的消耗速率与CH3OH的消耗速率之比为3:1 |
| D、容器内的密度保持不变 |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明溶液中:Ca2+、H+、Cl-、Fe2+ |
| B、能与金属铝反应发出氢气的溶液:K+、NO3-、Cl-、Fe3+ |
| C、由水电离出的c(H+)=1.0×10-12mol/L的溶液:Na+、Cu2+、HCO3-、NO3- |
| D、KW/c(H+)=0.1mol/L的溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
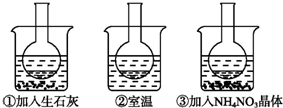 如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体.
如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、反应①中Cl2是还原剂 |
| B、反应①中碳元素被还原 |
| C、反应②中钛元素被氧化 |
| D、反应②中TiCl4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某种燃料电池的工作原理示意如图所示,a、b均为惰性电极.
某种燃料电池的工作原理示意如图所示,a、b均为惰性电极.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B、CO(g)的燃烧热是283.0kJ/mol,则有下列热化学方程式:2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol |
| C、需要加热才能发生的反应一定是吸热反应 |
| D、1mol甲烷燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com