
(15分)X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
(1) 化合物YX3的空间构型为____________; X原子的杂化轨道类型为_______.
(2)XW的电子式是_____________.
(3)XW与YX3反应生成一种盐,该盐水溶液的pH________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)______________________________.
(4)Z元素氢化物的沸点比H2O________(填“低”或“高”).Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式_
 _.
_.
(5)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0.将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的是________.
a.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.到达化学平衡后,升高温度,YX3的体积分数增大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解


| ||
| ||
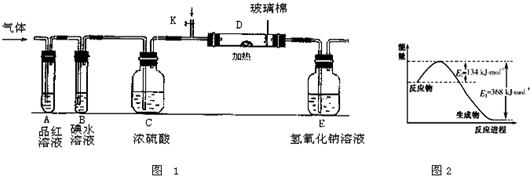
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
18 8 |
18 8 |
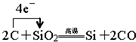

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com