
分析 (1)①2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
③4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
将方程式②+③×$\frac{3}{2}$-①×$\frac{1}{2}$得6NO2 (g)+O3(g)═3N2O5(g),据此计算焓变;
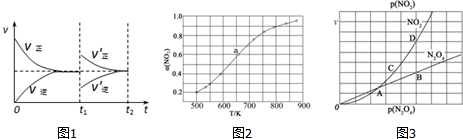
(2)根据速率与时间的变化图象可知,t1时刻改变某一条件后,反应N2O3(g)?NO2(g)+NO(g)正反应速率增大,逆反应速率减小,又该反应为体积可变的容器,所以根据图象中最后达到平衡的速率和之前速率相同,可知应该是恒压条件下充入反应物,据此分析判断;
(3)图中a点对应温度下,NO2的转化率是0.6,设原来NO2的物质的量为xmol,转化的物质的量为0.6xmol,
2NO2(g)?2NO(g)+O2(g),
开始 x 0 0
转化0.6xmol 0.6xmol 0.3xmol
平衡0.4xmol 0.6xmol 0.3xmol
则混合气体的物质的量=0.4xmol+0.6xmol+0.3xmol=1.3xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=$\frac{120kPa}{xmol}$×1.3xmol=156KPa,NO2的分压=156KPa×$\frac{0.4xmol}{1.3xmol}$=48KPa,
NO的分压=156KPa×$\frac{0.6xmol}{1.3xmol}$=72KPa,
O2的分压=156KPa×$\frac{0.3xmol}{1.3xmol}$=36KPa
根据该温度下反应的平衡常数Kp=$\frac{p(O{\;}_{2})p(NO){\;}^{2}}{p(NO{\;}_{2}){\;}^{2}}$计算;
(4)根据化学平衡常数Kp=$\frac{[p(NO{\;}_{2})]{\;}^{2}}{p(N{\;}_{2}O{\;}_{4})}$及二者的反应速率之比等于其计量数之比推断;满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点.
解答 解:(1)①2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
③4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
将方程式②+③×$\frac{3}{2}$-①×$\frac{1}{2}$得6NO2 (g)+O3(g)═3N2O5(g),△H=-199kJ•mol-1-57kJ•mol-1×$\frac{3}{2}$+113kJ•mol-1×$\frac{1}{2}$=-228kJ•mol-1,
故答案为:-228kJ•mol-1;
(2)A.该反应为体积可变的容器,所以根据图象中最后达到平衡的速率和之前速率相同,可知改变的条件应该是恒压条件下充入反应物,故A错误;
B.改变的条件应该是恒压条件下充入反应物,等效平衡,故平衡时反应物转化率不变,故B错误;
C.改变的条件应该是恒压条件下充入反应物,等效平衡,故平衡时二氧化氮体积分数不变,故C正确;
D.若t1时刻将容器的体积缩小至原容器的一半,则压强增大,正逆反应速率都增大,所以速率~时间图象与上图不同,故D错误;
故选:C;
(3)图中a点对应温度下,NO2的转化率是0.6,设原来NO2的物质的量为xmol,转化的物质的量为0.6xmol,
2NO2(g)?2NO(g)+O2(g),
开始 x 0 0
转化0.6xmol 0.6xmol 0.3xmol
平衡0.4xmol 0.6xmol 0.3xmol
则混合气体的物质的量=0.4xmol+0.6xmol+0.3xmol=1.3xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=$\frac{120kPa}{xmol}$×1.3xmol=156KPa,NO2的分压=156KPa×$\frac{0.4xmol}{1.3xmol}$=48KPa,
NO的分压=156KPa×$\frac{0.6xmol}{1.3xmol}$=72KPa,
O2的分压=156KPa×$\frac{0.3xmol}{1.3xmol}$=36KPa
化学平衡常数Kp=$\frac{p(O{\;}_{2})p(NO){\;}^{2}}{p(NO{\;}_{2}){\;}^{2}}$=$\frac{36×72{\;}^{2}}{48{\;}^{2}}$=81,
故答案为:81;
(4)反应N2O4(g)?2NO2(g),则化学平衡常数Kp=$\frac{[p(NO{\;}_{2})]{\;}^{2}}{p(N{\;}_{2}O{\;}_{4})}$,二者的反应速率之比等于其计量数之比,
则υ(NO2):υ(N2O4)=k2•p2(NO2):k1•p(N2O4)=2:1,又化学平衡常数Kp=$\frac{[p(NO{\;}_{2})]{\;}^{2}}{p(N{\;}_{2}O{\;}_{4})}$,
所以K1=$\frac{1}{2}$K2•Kp,
满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点,
故答案为:$\frac{1}{2}$K2•Kp;B点与D点;满足平衡条件υ(NO2)=2υ(N2O4).
点评 本题考查化学平衡有关计算,为高频考点,涉及平衡计算、盖斯定律等知识点,侧重考查学生分析计算及获取信息解答问题能力,难点是(3)题平衡常数的计算,注意分压的计算方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
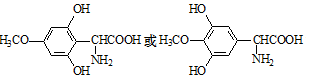 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2水,NaOH(aq) | B. | KMnO4(aq),氨水 | C. | H2O2溶液,氧化铜 | D. | HNO3(aq),氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | a | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②⑤⑥⑧ | C. | ②⑦⑧ | D. | ③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2g甲酸中,所含化学键的数目为0.8 NA | |
| B. | 常温下,28g Fe与足量的浓硝酸反应,转移的电子数为1.5NA | |
| C. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为NA | |
| D. | 标准状况下,22.4L己烷所含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL pH=13的氨水与10mL pH=l的盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | l0 mL0.1 mol/L NH4Cl溶液与5mL 0.2mol/LNaOH溶液混合:c(Cl-)=c(Na+)>c(OH-)>(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与10 mL pH=13的NaOH溶液混合:c(CH3COO-)=c(Na+)>c(OH-)>c(H+) | |
| D. | l0 mL 0.5mol/L CH3COONa溶液与6mL pH=0的盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com