
| A. | 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定过程中视线应一直注视锥形瓶内混合液颜色的变化 | |
| D. | 用酚酞做指示剂,溶液由无色变浅红色,半分钟不变色为滴定终点 |
分析 A.用蒸馏水洗净酸式滴定管后,必须再用标准液进行润洗,否则标准液会被稀释;
B.蒸馏水洗净锥形瓶后,不能用待测液润洗,否则会导致待测液中氢氧化钠的物质的量偏大;
C.滴定时,眼睛应注视锥形瓶内溶液的颜色变化,以便及时判断滴定终点;
D.酚酞遇碱变红色,溶液由红色变成无色,且分钟不变色为滴定终点.
解答 解:用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定,标准盐酸被稀释,浓度偏小,造成消耗的V(酸)偏大,根据c(碱)=$\frac{c(酸)×V(酸)}{V(碱)}$可知,计算出的c(碱)偏大,故A错误;
B.蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定,而后装入一定体积的NaOH溶液进行滴定,待测液的物质的量偏大,造成消耗的V(酸)偏大,根据c(碱)=$\frac{c(酸)×V(酸)}{V(碱)}$可知,计算出的c(碱)偏大,故B错误
C.滴定时,眼睛应注视锥形瓶内溶液的颜色变化,不需要注视滴定管内的液面变化,目的是准确判断滴定终点,故C正确;
D.滴定前锥形瓶中溶液为红色,滴定结束时溶液变为无色,则滴定终点时的现象为:溶液由红色变成无色,且分钟不变色,故D错误;
故选C.
点评 本题考查中和滴定的操作方法及误差分析,题目难度中等,注意明确酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色发生变化,且半分钟内不复原,为易错点.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用以下实验器材(规格和数量不限):烧杯、玻璃棒、胶头滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的实验 | |
| B. | 制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 | |
| C. | 向两支盛有KI3溶液的试管中分别加入淀粉和硝酸银溶液,前者溶液变蓝后者产生黄色沉淀,由此得出KI3溶液中存在平衡I3-?I2+I- | |
| D. | 科学家在研究物质微观结构的过程中先后使用了光学显微镜、电子显微镜、扫描隧道显微镜等观测仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
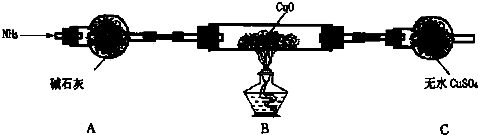
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
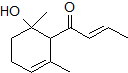 ,可用于制作香水.有关该化合物的下列说法正确的是( )
,可用于制作香水.有关该化合物的下列说法正确的是( )| A. | 分子式为C12H20O2 | B. | 该化合物可使酸性KMnO4溶液褪色 | ||
| C. | 该化合物可与NaOH溶液发生反应 | D. | 1 mol该化合物可与2 mol Br2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸跟氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O | |
| B. | 铁跟稀盐酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 在硫氢化钠溶液中加入稀硫酸溶液:S2-+2H+→H2S↑ | |
| D. | 碳酸钙溶于盐酸中:CaCO3+2H+→Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中的溶质是NH4Cl和NH3•H2O,则不等式c(NH4+)>c(Cl-)>c(NH3•H2O)>c(H+)一定正确 | |
| C. | 若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl | |
| D. | 若溶液中c(Cl-)=c(NH4+),则该溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 用酚酞作指示剂时,滴至溶液从红色变成无色即视为滴定终点 | |
| D. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com