
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4﹣ , HSO4﹣![]() H++SO42﹣ .
H++SO42﹣ .
请回答下列有关问题:
(1)Na2SO4溶液呈(填“弱酸性”、“中性”或“弱碱性”),其理由是(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为:
(3)在0.10mol/L的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
A.c(SO42﹣)+c(HSO4﹣)+c(H2SO4)=0.1mol/L
B.c(OH﹣)=c(H+)+c(HSO4﹣)
C.c(Na+)+c(H+)=c(OH﹣)+c(HSO4﹣)+2c(SO42﹣)
D.c(Na+)>c(SO42﹣)>c(OH﹣)>c(HSO4﹣)>c(H+)
【答案】
(1)碱性;SO42﹣+H2O=OH﹣+HSO4﹣
(2)HSO4﹣+Ba2+=BaSO4↓+H+
(3)B,C,D
【解析】根据硫酸的第一步电离是完全的:H2SO4=H++HSO4﹣ , 第二步电离并不完全:HSO4﹣![]() H++SO42﹣ , (1)①Na2SO4溶液中硫酸根离子易水解,所以溶液中存在SO42﹣+H2O
H++SO42﹣ , (1)①Na2SO4溶液中硫酸根离子易水解,所以溶液中存在SO42﹣+H2O ![]() OH﹣+HSO4﹣ , 导致溶液呈弱碱性,
OH﹣+HSO4﹣ , 导致溶液呈弱碱性,
所以答案为:弱碱性;SO42﹣+H2O ![]() OH﹣+HSO4﹣;
OH﹣+HSO4﹣;
②硫酸在溶液中电离出硫酸氢根离子,硫酸氢根离子和钡离子反应生成硫酸钡沉淀和氢离子,所以离子反应方程式为:HSO4﹣+Ba2+=BaSO4↓+H+ ,
所以答案为:HSO4﹣+Ba2+=BaSO4↓+H+;
③A.溶液中存在物料守恒,根据物料守恒得c(SO42﹣)+c(HSO4﹣)=0.1molL﹣1 , 硫酸钠溶液中不存在硫酸分子,所以A错误;
B.溶液中存在物料守恒2c(SO42﹣)+2c(HSO4﹣)=c(Na+),存在电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(HSO4﹣)+2c(SO42﹣),所以得c(OH﹣)=c(H+)+c(HSO4﹣),所以B正确;
C.液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH﹣)+c(HSO4﹣)+2c(SO42﹣),所以C正确;
D.硫酸钠溶液中只有少量的硫酸根离子水解,则c(SO42﹣)>(HSO4﹣),水解后溶液显示碱性,溶液中还存在水电离的氢氧根离子,则c(OH﹣)>c(HSO4﹣)>c(H+),所以溶液中离子浓度大小关系为:c(Na+)>c(SO42﹣)>c(OH﹣)>c(HSO4﹣)>c(H+),所以D正确;
所以答案为:BCD;
【考点精析】根据题目的已知条件,利用弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
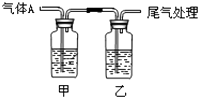
【题目】利用如图所示装置进行实验,有关现象和解释均正确的是( )
选项 | 足量 | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3H2O电离出OH﹣ |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铜悬浊液中存在如下平衡:Cu(OH)2 (s)Cu2+(aq)+2OH﹣(aq),常温下其Ksp=c(Cu2+)c2(OH﹣)=2×10﹣20mol2L﹣2 .
①某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 .
②要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第周期第族;Na和O形成1:1的化合物的电子式: . 该物质含有的化学键为: .
(2)用“>”或“<”填空:
稳定性 | 粒子半径 | 熔点 | 键的极性 |
NH3H2O | O2﹣Mg2+ | SO3 | H﹣O |
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr ![]() 3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
②放电时负极的电极反应式为:
(4)已知N4为正四面体结构,N﹣N键能为167kJmol﹣1 , N≡N键能为942kJmol﹣1 . 写出N4(g)转化为N2(g)的热化学方程式 . 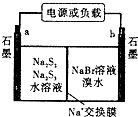
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要200mL2.0mol/L的碳酸钠溶液.请回答下列有关问题:
(1)实验中,下列仪器不必使用的是 (填写字母).
A.250mL容量瓶
B.洗瓶
C.托盘天平(药匙)
D.烧瓶
E.玻璃棒
(2)除上述仪器外,尚缺少的仪器或用品有、 .
(3)容量瓶上,除有刻度和容量规格外还应标注 . 容量瓶在使用前必须进行的实验操作是 .
(4)配制过程一般包括:计算、称量、溶解、转移、洗涤、定容、摇匀等步骤,其中所缺的关键步聚是 , 应在之后,之前.
(5)实验评价:
①若配制过程中,向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,对实验结果有何影响?(填写:偏大、偏小或不影响)
②若在滴加蒸馏水时,不慎超过刻度线,应如何处理? .
(6)计算:所需碳酸钠的质量.(要有过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程. 【实验】在0.1molL﹣l MgSO4 , 0.05molL﹣l﹣Al2( SO4)3的混合溶液中滴加0.5mol.L﹣1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.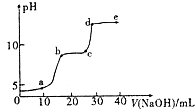
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 .
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3: 推测l:生成Mg( OH)2沉淀,消耗OH ﹣;
推测2:;
推测3.
若推测l符合实际情况,则a点之前反应的离子方程式为一,请据此描述Mg( OH)2 , A1( OH)3两种物质在水溶液中溶解性的差异.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42﹣ . 某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中不正确的是( )
A.该温度高于25℃
B.c(H+)=c(OH﹣)+c(SO42﹣)
C.水电离出来的c(H+)=1×10﹣10molL﹣1
D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com