
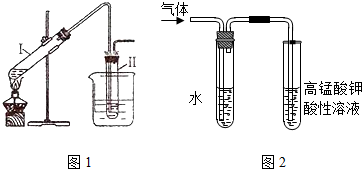
分析 ((1)氢溴酸与乙醇在加热时,发生取代反应生成溴乙烷和水;
(2)为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,需要密封、降低温度、冷凝回流等;
(3)溴乙烷与NaOH乙醇溶液共热的性质实验时,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能使高锰酸钾褪色,则利用水除去乙醇后,再检验乙烯.
解答 解:(1)氢溴酸与乙醇在加热时,发生取代反应生成溴乙烷和水,反应为HBr+C2H5OH$\stackrel{△}{→}$C2H5Br+H2O,
故答案为:HBr+C2H5OH$\stackrel{△}{→}$C2H5Br+H2O;
(2)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,图1中采取的措施有试管Ⅱ塞上带有导管的塞子并在其中加水、把试管Ⅱ放入盛有冷水的烧杯中、使用长导管等,
故答案为:试管Ⅱ塞上带有导管的塞子并在其中加水;把试管Ⅱ放入盛有冷水的烧杯中;
(3)溴乙烷与NaOH乙醇溶液共热的性质实验时,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能使高锰酸钾褪色,则用如图2装置进行实验的目的是验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物);图中右边试管中的现象是高锰酸钾溶液的紫红色褪去,水的作用是除去气体中混有的少量乙醇等杂质,
故答案为:验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物);高锰酸钾溶液的紫红色褪去;除去气体中混有的少量乙醇等杂质.
点评 本题考查物质的性质实验及制备实验,为高频考点,把握有机物的性质、实验装置的作用、实验技能为解答的关键,注意检验乙烯要排除乙醇的干扰,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
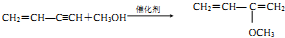 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(A) | n(B) | n(C) | ||
| ① | 700 | 4.0 | 1.0 | 1.80 |
| ② | 800 | 1.0 | 4.0 | 1.60 |
| ③ | 800 | 2.0 | 2.0 | a |
| ④ | 900 | 1.0 | 1.0 | b |
| A. | 实验①中,若10min达到平衡,则v(D)=9.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=3.2 | |
| C. | 实验③中,达到平衡时A的转化率为60% | |
| D. | 实验④中,达到平衡时,b<1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:| 元素 | Mn | Fe | |
| 电离能(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gFe与0.5 molCl2充分反应转移电子数为1.5NA | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 室温时,0.1 mol/L Na2CO3溶液中所含Na+数为0.2NA | |
| D. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA |
查看答案和解析>>
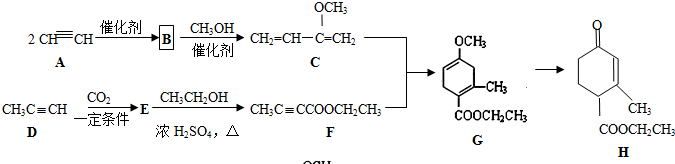
科目:高中化学 来源: 题型:解答题
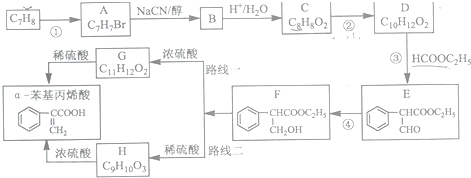


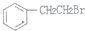 制备
制备 的合成路线.
的合成路线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com