
【题目】按要求回答下列问题:
(1)在标准状况下,V L H2 中含有 N 个氢分子,则阿伏加德罗常数为_____mol-1
(2)8.5 g氢氧根离子含有的电子数目为________。
(3)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D;现将16 g A与70 g B混合,充分反应后,生成2 mol D和一定量的C,则D的相对分子质量为_________。
(4)标准状况下,8.96L的CH4和CO的混合气体,该混合气体对氢气的相对密度是9.5,则混合气体平均摩尔质量为____________,混合气体中CH4与CO的体积比为____。
(5)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(用带字母的表达式回答)
【答案】![]() 3.01×1022 18 19g/mol 3:1
3.01×1022 18 19g/mol 3:1 ![]()
【解析】
(1)根据NA=![]() 进行计算;
进行计算;
(2)根据n=![]() 、N=nNA进行计算;
、N=nNA进行计算;
(3)根据质量守恒结合M=![]() 进行计算;
进行计算;
(4)根据V=nVm进行计算;
(5)根据c=![]() 进行计算。
进行计算。
(1)氢气物质的量为![]() =
=![]() mol,则N=
mol,则N=![]() mol×NA mol-1,故NA=
mol×NA mol-1,故NA=![]() mol-1;
mol-1;
(2)8.5 g氢氧根离子的物质的量为![]() ,氢氧根离子含有10个电子,故0.5mol氢氧根离子所含有的电子数目为0.5mol×10×6.02×1023=3.01×1022;
,氢氧根离子含有10个电子,故0.5mol氢氧根离子所含有的电子数目为0.5mol×10×6.02×1023=3.01×1022;
(3)根据质量守恒,生成D的质量为(8+32-22)g=18g,16gA完全参加反应需要B的质量为32×16÷8g=64g,B过量,因此产生D的质量为16×![]() g=36g,D的摩尔质量为
g=36g,D的摩尔质量为![]() g/mol=18g/mol;
g/mol=18g/mol;
(4)在标准状况下,8.96L的CH4和CO的混合气体的物质的量为![]() =0.4mol,二者对氢气相对密度是9.5,可知混合气体的平均相对分子质量为2×9.5=19,即混合气体平均摩尔质量为19g/mol;
=0.4mol,二者对氢气相对密度是9.5,可知混合气体的平均相对分子质量为2×9.5=19,即混合气体平均摩尔质量为19g/mol;
设混合气体中CH4的物质的量为nmol,则CO的物质的量为(0.4-n)mol,可知:16n+28(0.4-n)=19g/mol×0.4mol,解得:n=0.3mol,可知CH4的体积为0.3mol×22.4L/mol=6.72L;CO的体积为(0.4-n)mol×22.4L/mol=2.24L;混合气体中CH4与CO的体积比为6.72L:22.4L=3:1;
(5)HCl的物质的量为![]() =
=![]() mol,HCl的质量为
mol,HCl的质量为![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(
g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(![]() +1000)g,溶液的体积为
+1000)g,溶液的体积为 =
=![]() L,故所得溶液的物质的量浓度为
L,故所得溶液的物质的量浓度为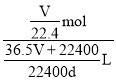 =
=![]() mol/L。
mol/L。


科目:高中化学 来源: 题型:
【题目】某同学用某化合物X(两种短周期元素组成的纯净物)进行了如下实验:

实验步骤②中还观测到生成黑色固体和无色无味气体,生成的溶液可作为建筑行业的一种黏合剂。
请回答:
(1)X的化学式是____,步骤①的离子方程式是___。
(2)步骤②的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
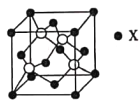
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )
A. 所占的体积由大到小的顺序是: H2>CH4>O2>CO2>SO2
B. 所含的电子数由多到少是:CO2>SO2>CH4>O2>H2
C. 密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D. 所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
①氧化还原反应的实质是电子的得失。
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下。
③标准状况下,1 L HCl和1 L H2O的物质的量相同。
④同温同压下,任何气体的分子间距离几乎相等。
⑤利用丁达尔现象可以区别溶液和胶体。
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同。
⑦在同温同体积时,气体物质的物质的量越大,则压强越大。
⑧气体的密度与气体的相对分子质量成正比。
A.④⑤⑦B.②③⑥⑦⑧C.①②③④D.①④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水使有色布条褪色,说明氯水中含有![]()
B. 向氯水中加入![]() 溶液产生白色沉淀,说明氯水中含有
溶液产生白色沉淀,说明氯水中含有![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向氢氧化钠溶液中滴加氯水,溶液黄绿色消失,说明氯水中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为 。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为 。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属 分子(选填“极性”“非极性”),其立体构型为 。
(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂。该晶体属于 晶体,三种元素电负性由大到小的顺序为(填元素符号) 。配体CO中σ键与π键数之比是 。

(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如上图所示,分子内的作用力不可能含有 (填序号)。
A离子键 B共价键 C金属键 D配位键 E氢键
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图所示,已知钨的密度为ρ g·cm-3,则每个钨原子的半径r= cm。(只需列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确书写离子方程式是学好化学的基本素养之一,下列离子方程式书写正确的是( )
A.氢氧化镁与稀硫酸反应:![]()
B.用饱和氯化铁溶液制取氢氧化铁胶体:![]()
C.石灰乳与碳酸钠溶液反应:![]()
D.向NaHSO4溶液中滴加Ba(OH)2溶液至刚好沉淀完全:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大。X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。则下列说法中不正确的是
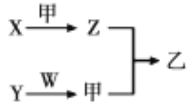
A. 沸点:W>X
B. 原子半径:D>B>C>A
C. C、D两种元素组成的化合物只含有离子键
D. A、B、C三种元素组成的化合物既可以是离子化合物,又可以是共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com