
 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.分析 (1)①硫在氧气中燃烧生成二氧化硫;
②将2mol/L的AgNO3溶液与0.5mol/L的Na2S溶液等体积混合,AgNO3过量,根据反应后溶液中银离子浓度结合Ksp[Ag2S]计算;
(2)①硫原子之间形成一个共用电子对,硫离子与钠离子之间以离子键结合;
②Na2Sx 失电子,NaClO得电子,根据得失电子守恒计算;
(3)已知常温下,某亚硫酸氢钠溶液pH=6,溶液显酸性,溶液中存在电荷守恒和物料守恒,据此计算得到;
(4)①硫元素和氧元素能形成多种酸根离子,其中有一种离子能与盐酸发生氧化还原反应是硫代硫酸根离子和酸反应生成二氧化硫、硫单质和水;
②硫酸的第二步电离是不完全的,则Na2SO4溶液中硫酸根离子水解生成硫酸氢根离子,促进水的电离平衡正向进行溶液显碱性;
(5)利用双层膜法电解亚硫酸钠溶液得到硫酸和氢氧化钠,则 电解时的阳极反应是亚硫酸根离子失电子发生氧化反应生成硫酸根离子.
解答 解:(1)①硫在氧气中燃烧生成二氧化硫,反应的化学方程式为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
②将2mol/L的AgNO3溶液与0.5mol/L的Na2S溶液等体积混合,AgNO3过量,设溶液体积为1L,则反应2Ag++S2-=Ag2S↓后溶液中银离子浓度c(Ag+)=0.5mol/L,常温下Ksp[Ag2S]=c2(Ag+)c(S2-)=6.3×10-50,c(S2-)=$\frac{6.3×1{0}^{-50}}{0.5mol/L}$=2.52×10-49mol/L,
故答案为:2.52×10-49mol/L;
(2)①化合物Na2S3中,各原子(或离子)最外层均达到8电子稳定结构,硫原子间分别形成一对共用电子对,和钠离子键形成离子键,电子式为 ,故答案为:
,故答案为: ;
;
②多硫化钠Na2Sx (x≥2)在碱性溶液中可被NaClO氧化为Na2SO4,氯元素化合价+1价变化为-1价,ClO-~Cl-~2e-,硫元素化合价变化为:Na2Sx~xSO42-~(6x+2)e-,反应中Na2Sx 与NaClO的物质的量之比为1:16,电子守恒得到16×2=1×(6x+2),
x=5,
故答案为:5;
(3)某亚硫酸氢钠溶液pH=6,溶液中存在电荷守恒:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),物料守恒:c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),则该溶液中SO32-与H2SO3浓度的差值[SO32-]-[H2SO3]=c(H+)-c(OH-)=(10-6-10-8)mol/L,
故答案为:10-6-10-8;
(4)①硫元素和氧元素能形成多种酸根离子,其中有一种离子能与盐酸发生氧化还原反应是硫代硫酸根离子和酸反应生成二氧化硫、硫单质和水,反应的离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
②硫酸的第二步电离是不完全的,电离方程式H2SO4=H++HSO4-,HSO4-?H++SO42-,则Na2SO4溶液中硫酸根离子水解生成硫酸氢根离子,促进水的电离平衡正向进行溶液显碱性,故答案为:碱性;
(5)电解亚硫酸钠溶液得到硫酸和氢氧化钠,则 电解时的阳极反应是亚硫酸根离子失电子发生氧化反应生成硫酸根离子,阳极反应方程式为:SO32--2e-+H2O=SO42-+2H+,
故答案为:SO32--2e-+H2O=SO42-+2H+.
点评 本题考查了溶度积常数计算、电解质溶液中电荷守恒、物料守恒的分析、氧化还原反应电子守恒的计算、电解池原理等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国目前使用的主要能源是化石能源 | |
| B. | 氢能源的优点有:热量值高、对环境友好 | |
| C. | 核能发电是解决能源危机的最佳途径 | |
| D. | 太阳能的缺点有:能量密度低、稳定性差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200℃ | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
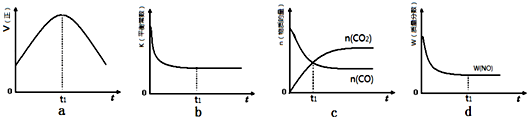
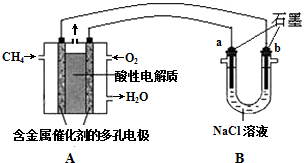
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
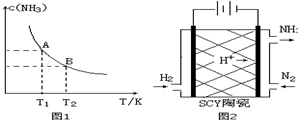
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
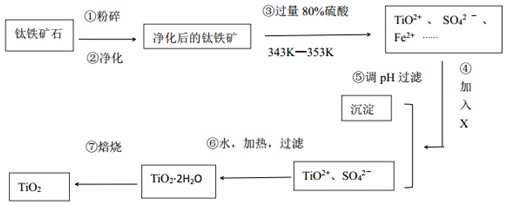
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com