
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
分析 ①钠和水反应生成的氢氧化钠和FeCl2溶液发生复分解反应生成Fe(OH)2,最终生成红褐色的Fe(OH)3;
②Al(OH)3具有两性,可与NaOH反应生成NaAlO2,过量NaOH溶液和AlCl3溶液混合,先有白色沉淀,后沉淀溶解;
③少量Ca(OH)2投入过量NaHCO3溶液中发生复分解反应有碳酸钙是白色沉淀生成;
④碳酸酸性比氢氧化铝强,过量CO2通入Na[Al(OH)4]溶液中生成氢氧化铝白色沉淀.
解答 解:①金属钠投入到烧杯中的FeCl2溶液中,发生的反应为:2Na+2H2O=2NaOH+H2 ↑,2NaOH+FeCl2=Fe(OH)2 ↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以最终生成的沉淀是红褐色的,所以不符合,故①错误;
②过量NaOH溶液和AlCl3溶液混合,发生的反应是:3OH+Al3+=Al(OH)3↓,AlOH3+OH-=AlO2-+2H2O,所以最终没有沉淀生成,故②错误;
③少量Ca(OH)2投入过量NaHCO3溶液中发生的反应为:Ca(OH)2+NaHCO3=CaCO3 ↓+H2O+NaOH,碳酸钙是白色沉淀,所以有白色沉淀生成,故③正确;
④Na[Al(OH)4]溶液通入过量的二氧化碳,由于碳酸酸性比氢氧化铝强,所以生成氢氧化铝白色沉淀和碳酸氢钠,故④正确;
故选A.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意③为易错选项,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 25% | C. | <25% | D. | >25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: | B. | 苯的最简式:CH | ||
| C. | 乙烯的分子式:CH2=CH2 | D. | 乙醇的结构简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
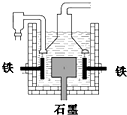 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不相同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
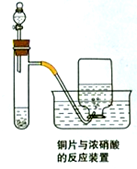 如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| C. | 1 mol-CH3 含有9 mol 电子 | |
| D. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
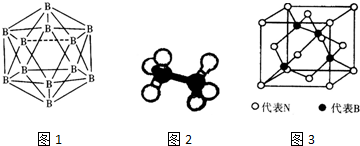
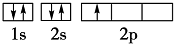 ,核外有5种运动状态不同的电子.
,核外有5种运动状态不同的电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com