
分析 (1)氯化铵溶液显酸性,铵根离子水解浓度减小,但是水解程度较小;
(2)铵根离子水解溶液 显酸性,氧化铁与氢离子反应生成水和铁离子;
(3)中性溶液中存在c(H+)=c(OH-),常温下c(H+)=c(OH-)=10-7 mol/L;根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知:c(NH4+)=c(Cl-),混合后溶液体积增大一倍,所以溶液中c(Cl-)=0.5bmol/L,c(NH3•H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.5bmol/L,最后根据Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$进行计算.
解答 解:(1)氯化铵溶液显酸性,铵根离子水解浓度减小,但是水解程度较小,所以氯化铵稀溶液中微粒浓度最大的是水,其次为氯离子,则溶液中所有微粒浓度排序为c(H2O)>c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-);
故答案为:c(H2O)>c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-);
(2)铵根离子水解溶液显酸性,其水解方程式为:NH4++H2O?H++NH3•H2O,氧化铁与氢离子反应生成水和铁离子,其反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
故答案为:NH4++H2O?H++NH3•H2O;Fe2O3+6H+=2Fe3++3H2O;
(3)混合液为中性,则c(H+)=c(OH-),在常温下c(H+)=c(OH-)=10-7 mol/L;
根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知:c(NH4+)=c(Cl-),混合后溶液体积增大一倍,则溶液中c(Cl-)=c(NH4+)=0.5amol/L,
所以混合液中c(NH3•H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.5bmol/L,
所以常温下NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.5a×1{0}^{-7}}{0.5a-0.5b}$=$\frac{a}{a+b}$×10-7,
故答案为:$\frac{a}{a+b}$×10-7.
点评 本题考查了溶液中离子浓度大小比较、电离常数的计算,题目难度中等,注意掌握盐的水解原理及其应用,明确电荷守恒、物料守恒、盐的水解原理在判断溶液中离子浓度大小中的应用方法,试题有利于培养学生灵活应用所学知识的能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:与氢气混合加热,把乙烯转化为乙烷 | |
| B. | 除去苯中的少量乙烯:加入浓溴水振荡静置后过滤,除去二溴乙烯 | |
| C. | 为加快反应速率,制乙炔时用食盐水代替水 | |
| D. | 提取碘水中的碘,加入CCl4振荡静置分层后,取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.6g | B. | 15.2g | C. | 18.8g | D. | 21.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核 | B. | 原子 | ||
| C. | 胶体粒子 | D. | 悬浊液的分散质粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界硅元素的贮量丰富,并存在大量的单质硅 | |
| B. | 硅可由二氧化硅还原制得 | |
| C. | 二氧化硅晶体--水晶可用于制造光学仪器等 | |
| D. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
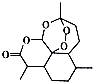
| A. | 属于芳香族化合物 | B. | 能存在于热的氢氧化钠溶液中 | ||
| C. | 易溶于氯仿等有机溶剂 | D. | 分子结构中只含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下不一定能够自发进行 | |
| B. | 合成氨反应需使用催化剂,目的是促进该反应平衡向生成氨的方向移动 | |
| C. | 0.1 mol•L-1Na2CO3溶液在35℃时碱性比25℃强,说明Na2CO3水解是吸热反应 | |
| D. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com