
 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: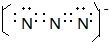 ;
; ;
;分析 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,A是宇宙中含量最多的元素,则A是H元素;
B元素能形成的化合物种类最多,则B是C元素;
E和D形成的某化合物是呼吸面具中气的来源,为过氧化钠,E原子的半径是所在周期最大的,D为O元素,E为Na元素,C元素原子序数大于B而小于D,为N元素;
F基态原子有6个来成对电子,则F为Cr元素;
(1)B的一种核素在考古中有重要应用,该原子有6个质子、8个中子,质量数为14;
(2)E+的水合离子中,提供孤电子对的原子是O原子;
(3)F元素在周期表中的位置是第四周期、第VIB族;
(4)原子个数相同、价电子数相同的微粒互为等电子体,N3-与二氧化碳互为等电子体,根据二氧化碳电子式书写该离子电子式;
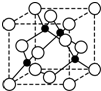
(5)根据图知,距离每个氯离子最近的铜原子有4个;
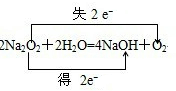
(6)过氧化钠和二氧化碳反应生成碳酸钠和氧气;
(7)CrO2-在碱性溶液中有较强的还原性,可以被Na2O2氧化成CrO42-,该反应中过氧化钠是氧化剂、CrO2-是还原剂,根据转移电子相等书写离子方程式.
解答 解:A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,A是宇宙中含量最多的元素,则A是H元素;
B元素能形成的化合物种类最多,则B是C元素;
E和D形成的某化合物是呼吸面具中气的来源,为过氧化钠,E原子的半径是所在周期最大的,D为O元素,E为Na元素,C元素原子序数大于B而小于D,为N元素;
F基态原子有6个来成对电子,则F为Cr元素;
(1)B的一种核素在考古中有重要应用,该原子有6个质子、8个中子,质量数为14,该原子为${\;}_{6}^{14}$C,
故答案为:${\;}_{6}^{14}$C;
(2)E+的水合离子中,水分子中O原子含有孤电子对,所以提供孤电子对的原子是氧原子,故答案为:氧原子;
(3)F元素在周期表中的位置是第四周期、第VIB族,故答案为:第四周期第VIII族;
(4)原子个数相同、价电子数相同的微粒互为等电子体,N3-与二氧化碳互为等电子体,根据二氧化碳电子式书写该离子电子式为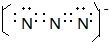 ,
,
故答案为: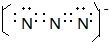 ;
;
(5)根据图知,距离每个氯离子最近的铜原子有4个,所以氯离子的配位数是4,故答案为:4;
(6)过氧化钠和二氧化碳反应生成碳酸钠和氧气,该反应中过氧化钠中O元素化合价由-1价变为0价、-2价,转移电子数为1,其转移电子方向和数目为 ,
,
故答案为: ;
;
(7)CrO2-在碱性溶液中有较强的还原性,可以被Na2O2氧化成CrO42-,该反应中过氧化钠是氧化剂、CrO2-是还原剂,根据转移电子相等书写离子方程式为2CrO2-+2H2O+3Na2O2=2CrO42-+6Na++4OH-,
故答案为:2CrO2-+2H2O+3Na2O2=2CrO42-+6Na++4OH-.
点评 本题考查较综合,涉及晶胞计算、氧化还原反应、电子式的书写等知识点,侧重考查学生分析判断、知识迁移能力、空间想象能力,难点是配位数的计算和(7)题离子方程式书写,题目难度中等.


科目:高中化学 来源: 题型:解答题
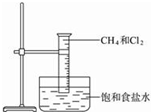 图是研究甲烷与氯气反应的实验装置图
图是研究甲烷与氯气反应的实验装置图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热需要看反应物和生产物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应都伴随能量变化,而且都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成尿酸钠晶体的反应为放热反应 | B. | 形成尿酸钠晶体的反应为吸热反应 | ||
| C. | 尿酸钠溶液呈酸性 | D. | 尿酸钠晶体一定难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 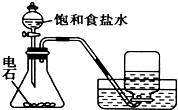 实验室制取乙炔 | B. | 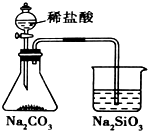 能证明非金属性Cl>C>Si | ||
| C. | 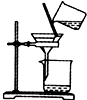 分离出Cl2与KI溶液反应生成的碘 | D. | 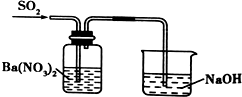 洗气瓶中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
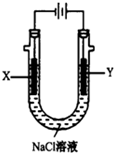
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com