
【题目】在实验室进行下列有关的物质制备中,理论上正确、操作上可行、经济上合理的是
A.C![]() CO
CO![]() CO2
CO2![]() Na2CO3
Na2CO3
B.Cu![]() Cu(NO3)2溶液
Cu(NO3)2溶液![]() Cu(OH)2
Cu(OH)2
C.Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3溶液
Fe2(SO4)3溶液
D.CaO![]() Ca(OH)2溶液
Ca(OH)2溶液![]() NaOH溶液
NaOH溶液
【答案】D
【解析】
A.碳不完全燃烧可生成一氧化碳,一氧化碳高温下与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠;理论上正确,反应过程中产生、利用污染环境的物质CO,不符合绿色化学,一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸,操作上较为复杂,故A错误;
B.铜与与硝酸银反应可生成硝酸铜,硝酸铜与氢氧化钠可生成氢氧化铜沉淀;理论上正确,操作上也较简便,但利用硝酸银、氢氧化钠制取氢氧化铜,经济上不合理,故B错误;
C.铁在氧气中燃烧生成四氧化三铁而不能生成三氧化二铁,因此该方案在理论上就是错误的,故C错误;
D.氧化钙与水反应可生成氢氧化钙,氢氧化钙与碳酸钠反应可生成氢氧化钠;理论上正确,操作也只需要加入液体较为简便,利用碳酸钠获得氢氧化钠,经济上也合理,符合绿色化学,故D正确;
答案选D。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
【题目】氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如图实验制备卤砂并进行元素测定。
Ⅰ.实验室制备卤砂所需的装置如图所示,装置可重复选用。

(1)装置接口连接顺序是___→a;b←___。
(2)C装置的作用是___,D装置盛装的物质是___。
(3)写出用上述装置制备氨气的一组试剂:___。
Ⅱ.测定卤砂中Cl元素和N元素的质量之比。
该研究小组准确称取ag卤砂,与足量氧化铜混合加热,充分反应后把气体产物按如图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重bg。

(4)E装置内的试剂为___,卤砂与氧化铜混合加热反应的化学方程式为___。
(5)卤砂中Cl元素和N元素的质量之比为___(用含b、V的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将ag卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1molSO3固体放热![]() kJ
kJ
B.2Q1<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、SiO32-、SO42-
B. 1.0mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl-
C. 在c(OH-):c(H+)=1×1012的溶液: NH4+、Ca2+、Cl-、K+
D. 滴入酚酞试剂不变色的溶液:Na+、CO32-、NO3-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是人体中一种重要元素,一般情况下,钠约占成人体重的0.15%。钠元素对应的化合物因组成与结构性质差异很大。
(1)钠原子核外电子共占据_______个轨道,写出同一周期中原子核外M层上有2个未成对电子的元素其原子最外层电子排布式_______。
(2)氯化钠的熔点比氯化钾的_______(填“高”或“低”),原因是________。
(3)实验室可用浓氨水与氢氧化钠固体反应制取氨气,试用平衡原理分析氢氧化钠的作用:___。
(4)氟化钠溶液中,不存在的微粒间作用力是_________(填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力
(5)卡斯纳法制取金属钠的原理是:以氢氧化钠为原料,放入铁质容器中熔化,在稀有气体的保护下,以镍为阳极,铁为阴极,在阴极析出金属钠。写出反应的化学方程式为:_______。其中,氧化产物是:_____,若反应转移0.8mol电子,至少消耗______g NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________:
(2)过程I 加入铁屑的主要作用是___________,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是___________________;
(3)过程II中发生反应的化学方程式为_________________________;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
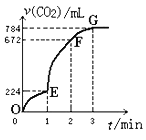
A.F点收集到的CO2的量最多
B.OE段表示的平均速率最快
C.EF段用盐酸表示该反应的平均反应速率为0.4mol·L-1min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com