

分析 (1)SO2(g)和H2(g)反应生成S(s)和H2O(g)的方程式为:SO2(g)+2H2(g)=S(s)+2H2O(g),该反应可由已知的热化学方程式推导,根据盖斯定律计算该反应的焓变;
(2)①根据装置图分析,电解池阴极发生的反应为物质得到电子被还原,注意到装置中存在SO42-,通入预氧化后的烟道气,即SO3,和氧气,反应为SO3和O2反应,得到电子生成SO42-,据此写出电极反应方程式;
②反应将SO2转化为SO3,是氧化还原反应,根据反应的电子得失守恒和电极反应方程式计算;
(3)①根据图2,当废气中的NO含量增加时,好氧硝化反法的脱氮率呈现先降低后逐渐增大,而厌氧反硝化法的脱氮率逐渐降低,据此判断;
②根据图3,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,可能原因考虑金属离子对反应的催化效果;
(4)①NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝,温度高于60℃后,NO去除率随温度升高而下降,考虑到H2O2在温度高时会分解,导致反应NO去除率下降,据此分析;
②废气中的SO2与NaClO2反应,NaClO2具有氧化性,SO2具有还原性,发生氧化还原反应,生成Cl-,SO42-,据此写出反应的离子方程式.
解答 解:(1)已知:①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H1=a kJ/mol,
②H2S(g)═H2(g)+S(s)△H2=b kJ/mol,
③H2O(l)═H2O(g)△H3=c kJ/mol,
SO2(g)和H2(g)反应生成S(s)和H2O(g)的方程式为:SO2(g)+2H2(g)=S(s)+2H2O(g),改反应可由①-②×2+③×2得到,根据盖斯定律,该反应的焓变为△H=△H1-2△H2+2△H3=(a-2b+2c)kJ/mol,
故答案为:SO2(g)+2H2(g)=S(s)+2H2O(g)△H=(a-2b+2c)kJ/mol;
(2)①根据装置图分析,电解池阴极发生的反应为物质得到电子被还原,注意到装置中存在SO42-,通入预氧化后的烟道气,即SO3,和氧气,反应为SO3和O2反应,得到电子生成SO42-,则阴极的电极反应方程式为:2SO3+O2+4e-=2SO42-,
故答案为:2SO3+O2+4e-=2SO42-;
②反应将SO2转化为SO3,是氧化还原反应,根据装置,扫出气中含有SO3和O2,其中SO3可转变为H2SO4,电解过程中转移1mol电子,阴极反应式为:2SO3+O2+4e-=2SO42-,则反应产生SO42-的物质的量为0.5mol,则制得的硫酸的质量为m=0.5mol×98g/mol=49g,用水吸收最多可制得质量分数70%的硫酸的质量为49g÷70%=70g,
故答案为:70;
(3))①根据图2,当废气中的NO含量增加时,好氧硝化反法的脱氮率呈现先降低后逐渐增大,而厌氧反硝化法的脱氮率逐渐降低,因此宜选用好氧硝化法提高脱氮效率,
故答案为:好氧硝化;
②根据图3,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,考虑金属离子对反应的催化效果,则可能的原因是
Fe2+、Mn2+对该反应有催化作用,
故答案为:Fe2+、Mn2+对该反应有催化作用;
(4))①NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝,温度高于60℃后,NO去除率随温度升高而下降,考虑到H2O2在温度高时会分解,导致反应NO去除率下降,则温度高于60℃后,NO去除率随温度升高而下降的原因为温度升高,H2O2分解速率加快,
故答案为:温度升高,H2O2分解速率加快;
②废气中的SO2与NaClO2反应,NaClO2具有氧化性,SO2具有还原性,发生氧化还原反应,生成Cl-,SO42-,则反应的离子方程式为:2H2O+ClO2-+2SO2=Cl-+2SO42-+4H+,
故答案为:2H2O+ClO2-+2SO2=Cl-+2SO42-+4H+.
点评 本题考查化学原理部分知识,包含热化学方程式的书写,盖斯定律的简单应用,电化学知识,电极方程式的书写及计算,氧化还原反应方程式的书写和配平.题目涉及的知识点较多,较为综合,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cu+2AgNO3═Cu(NO3)2+2Ag | D. | BaCl2+Na2SO4═BaSO4↓+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
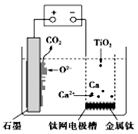 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是| A. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| B. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| C. | 若用铅蓄电池作供电电源,“一”接线柱应连接Pb电极 | |
| D. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li与Mg原子半径比较接近 | |
| B. | Be与冷水剧烈反应 | |
| C. | Be(OH)2能与NaOH溶液反应 | |
| D. | Li加热时与O2反应生成的产物主要是Li2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中有三种官能团 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 分子中两个苯环一定处于同一平面 | |
| D. | 1 mol化合物X与足量钠反应能生成标准状况下11.2L氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com