
| A. | 有单质参加的反应一定是氧化还原反应 | |
| B. | 燃烧反应必须有氧气作氧化剂 | |
| C. | 2Fe+3Cl2═2FeCl3; Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS 由此可以判断氧化性:Cl2>S | |
| D. | Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg |
分析 A.有单质参加反应,不一定存在元素的化合价变化;
B.燃烧反应不一定有氧气参加;
C.与变价金属反应生成化合物中金属的价态越高,非金属的氧化性越强;
D.还原性与失去电子的多少无关.
解答 解:A.有单质参加反应,不一定存在元素的化合价变化,如氧气转化为臭氧为非氧化还原反应,故A错误;
B.燃烧反应不一定有氧气参加,如氯气在氢气中燃烧,故B错误;
C.与变价金属反应生成化合物中金属的价态越高,非金属的氧化性越强,则氯化铁中Fe元素的化合价高,则氧化性:Cl2>S,故C正确;
D.还原性与失去电子的多少无关,与失去电子的难易有关,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金属镁能在CO2中燃烧,则金属钠也能在CO2中燃烧 | |
| B. | 金属钠与水反应产生NaOH和H2,则金属铜与水反应也能产生Cu(OH)2和H2 | |
| C. | Cl2+H2O?HCl+HClO是氧化还原反应,则ICl+H2O?HCl+HIO也是氧化原反应 | |
| D. | CO2与H2O反应生成H2CO3,则SiO2与H2O反应也可以生成H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 2:3 | C. | 1:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
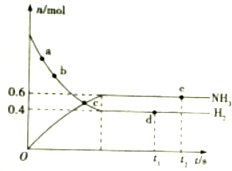 对于密闭容器中的反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)(正反应是放热反应),在673K,30MPa下n(NH3)和n(H2)随时间变化关系如图所示.
对于密闭容器中的反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)(正反应是放热反应),在673K,30MPa下n(NH3)和n(H2)随时间变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
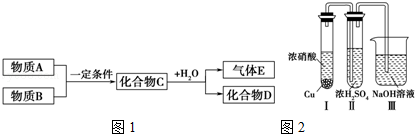
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com