
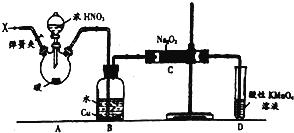
分析 以木炭、浓硝酸、水和铜为原料制备硝酸钠,由制备实验装置可知,实验开始前通入一段时间氮气,排出装置中的空气,防止NO被氧化,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡,B中生成NO,C中发生2NO+Na2O2═2NaNO2,最后D中高锰酸钾吸收过量NO,并结合C~4NO2~NO~Na2O2~NaNO2计算.
解答 解:(1)A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,为防止装置中空气中的氧气氧化生成的一氧化氮,应先通入氮气排尽装置内的空气,
故答案为:氮气;排尽空气,以免生成的一氧化氮被空气中的氧气氧化;
(2)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,所以会看到的现象为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝;
故答案为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝;
(3)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)D装置中高锰酸钾氧化一氧化氮生成硝酸根,本身被还原为二价锰离子,离子方程式:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
故答案为:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
(5)一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加盛有碱石灰的装置E,碱石灰能够吸收二氧化碳和水蒸气;
故答案为:NaOH;碱石灰;
(6)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2═2NaNO2,则有C~4NO2~NO~Na2O2~NaNO2,所以1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭的质量为$\frac{3.12g}{78g/mol}$×12g/mol=0.72g,
故答案为:0.72.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧,发出白光,放出热量,产生能使澄清石灰水变浑浊的气体 | |
| B. | 细铁丝在空气里剧烈燃烧,火星四射,生成黑色固体物质 | |
| C. | 硫在氧气中燃烧,发出黄色火焰,生成无色有刺激性气味的气体 | |
| D. | 加热铜绿时,生成黑色氧化铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱 | B. | 食用醋 | C. | 氯化铵 | D. | 纯碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与盐酸反应生成氢气 | B. | 氢氧化铝溶于强碱溶液 | ||
| C. | 氢氧化铝溶于强酸溶液 | D. | 铝热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com