
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | 只有② |
分析 常温、常压下,气体摩尔体积相同,体积相同的甲、乙两容器中含有的气体的物质的量一定相等,则两个容器内含有的气体分子数相等,但是含有的原子数一定不相等;甲中充满NH3和乙中充满H2和N2的混合气体密度相同,说明氮气和氢气的平均摩尔质量等于氨气的,则乙中N(H2):N(N2)=3:1、两容器内N(H):N(N)=3:1,据此进行判断.
解答 解:常温、常压下,气体摩尔体积相同,体积相同的甲、乙两容器中含有的气体的物质的量一定相等,
①两容器内气体的物质的量相等,而氨气为3原子分子,氮气和氢气为双原子分子,所以两容器内原子总数一定不相等,故①错误;
②由于两容器内气体的物质的量相等,则两容器内分子总数一定相同,故②正确;
③若两个容器内的气体密度相同,则两容器内气体的平均摩尔质量相同,则氮气和氢气的物质的量之比为1:3,即:N(H2):N(N2)=3:1,故③正确;
④根据③的分析可知,两容器内N(H):N(N)=3:1,故④正确;
故选C.
点评 本题考查了阿伏伽德罗常数定律及其推论,题目难度中等,明确阿伏伽德罗常数定律及其推论的内容为解答关键,注意掌握密度与摩尔质量之间的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于盐酸中:Al+2H+=Al3++H2↑ | |
| B. | 碳酸钙溶于硝酸中:2H++CO${\;}_{3}^{2-}$=CO2↑+H2O | |
| C. | 硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO${\;}_{3}^{-}$=CO2↑+H2O | |
| D. | 在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 X>Y>Z | |
| B. | 非金属性 X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是物质粒子的数量的简称 | |
| B. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| C. | 我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔 | |
| D. | 1mol H2中含2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +Br2→
+Br2→ ,反应类型为加成反应.
,反应类型为加成反应.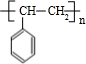 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
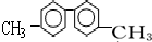
| A. | 该烃分子中有六种不同环境的氢原子 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使高锰酸钾和溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
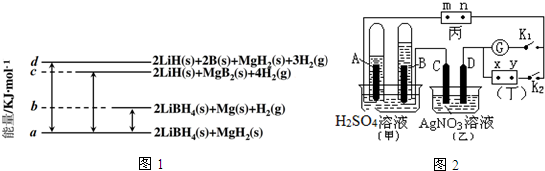
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com