
 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应.分析 (1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,热分解法:Hg、Ag;
(2)精炼铜时,粗铜为阳极,纯铜为阴极;
(3)①Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,原电池反应比化学反应速率快;
②所给四种溶液中只Zn只能置换出Ag;
(4)①根据电极反应判断阴极产物;
②根据两极的反应书写电解反应式.
解答 解:(1)Na、Mg常用电解法冶炼,Fe用热还原法冶炼,Ag用热分解法冶炼,故答案为:cd;
(2)精炼铜时,粗铜为阳极,纯铜为阴极,则a为阳极,连接电源正极,b为阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,
故答案为:正;Cu2++2e-=Cu;
(3)①Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,而加快化学反应速率,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率;
②所给四种溶液中只Zn只能置换出Ag,即Ag2SO4与CuSO4溶液具有相似的作用,故答案为:Ag2SO4;
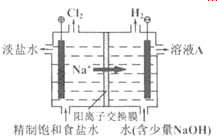
(4)①电解饱和食盐水时,阴极反应式为:2H2O+2e-═2OH-+H2↑,阳极反应式为:2Cl--2e-═Cl2↑,阴极产物为NaOH和H2,阳极产物是Cl2,据此可以确定溶液A的溶质是NaOH,故答案为:NaOH;
②根据阳极极和阴极的反应式可得电解反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
点评 本题考查较为综合,涉及金属的冶炼、电解以及氧化还原反应等知识,为高频考点,侧重于学生的分析能力的考查,注意把握电化学原理,从化合价的角度认识氧化还原反应,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 | |
| C. | 随核电荷数的增加,碱金属的熔沸点逐渐降低 | |
| D. | 溴单质与水的反应比氟单质与水的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.0g氯化钠固体 | |
| B. | 将干燥的氯气依次通过干燥红色布条和湿润红色布条检验氯气能否与水发生反应 | |
| C. | 用100mL容量瓶配制0.5mol/L KCl溶液前要检查容量瓶是否漏水 | |
| D. | 将4g氢氧化钠固体在100mL容量瓶中溶解,配制1mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 用量筒量取12.12mL的盐酸 | |
| D. | 称量时,称量物应放在托盘天平的左盘,砝码放在托盘天平的右盘中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2通入含1molFeBr2的溶液中 $C{l_2}+F{e^{2+}}+2B{r^-}=F{e^{3+}}+B{r_2}+2C{l^-}$ | |
| B. | 用大理石跟稀盐酸制二氧化碳:CO32-+2H+=H2O+CO2↑ | |
| C. | 碳酸氢钠溶液中加入过量澄清石灰水:2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O | |
| D. | 氧化镁与盐酸混合:MgO+2H+=Mg2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.6gCH4含有的电子数目为NA | |
| B. | 标准状况下,2.2 LCCl4含有的碳原子数目为0.1NA | |
| C. | 101kPa、0℃时,22.4LH2中氢原子数为NA个 | |
| D. | 1mol/L 的NaOH溶液中,Na+的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com