
| 物质类别 | 分类依据 | |
| A | 酸 | 电离时能否产生氢离子 |
| B | 碱性氧化物 | 是否属于金属氧化物 |
| C | 胶体 | 能否发生丁达尔现象 |
| D | 电解质 | 在水溶液中或熔化状态下能否电离 |
| A. | A | B. | B | C. | C | D. | D |
分析 电离时生成的阳离子全部是H+的化合物为酸;
能跟酸起反应,生成一种盐和水的氧化物叫碱性氧化物(且生成物只能有盐和水,不可以有任何其它物质生成)为碱性氧化物;
分散系依据分散质粒度大小分为胶体、溶液和浊液;
在水溶液中或熔化状态下能够导电的化合物为电解质,在水溶液中和熔化状态下都不导电的化合物为非电解质.
解答 解:A.电离时生成的阳离子全部是H+的化合物为酸,硫酸氢钠电离产生氢离子,不属于酸,故A错误;
B.金属氧化物不一定是碱性氧化物,如过氧化钠,故B错误;
C.分散系依据分散质粒度大小分为胶体、溶液和浊液,分散质粒度介于1-100nm之间的分散系为胶体,故C错误;
D.依据在水溶液中或熔化状态下能否电离可以将化合物分为电解质与非电解质,故D正确;
故选D.
点评 本题考查了物质的分类依据,明确酸、碱、碱性氧化物、电解质、非电解质的概念,熟悉分散质分类标准是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾、硫酸铜、澄清石灰水 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、空气、熟石灰 | D. | 硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
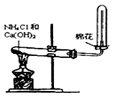 | 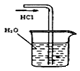 | 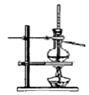 | 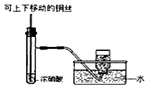 |
| A.制备少量氨气 | B.吸收HCl | C.分离苯和乙醇的混合物 | D.制备并收集少量NO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是钠盐 | B. | Na2CO3是含氧酸盐 | ||
| C. | Na2CO3是碳酸盐 | D. | Na2CO3是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 硫酸溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4 | |
| D. | 硝酸银溶液与氯化钠溶液反应:Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
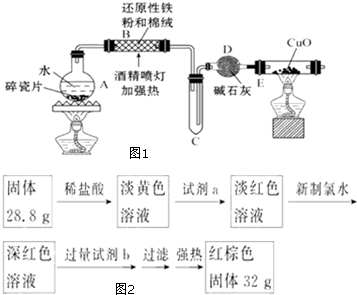 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com