
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
分析 据有机物属于酯类,且分子结构中有甲基和苯环,则应含有-COO-官能团,则取代基分别为-CH3和-OOCH或-OOCCH3或-COOCH3,有2个取代基时,有邻、间、对三不同结构,据此进行解答.
解答 解:由题目要求“属于酯类且分子结构中有-CH3和苯环”可知,邻甲基苯甲酸(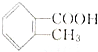 )的同分异构体中应含有CH3-C6H4-OOCH(-C6H4-为苯环)的结构,有邻、间、对三种同分异构体或C6H5-OOCCH3或C6H5-COOCH3,
)的同分异构体中应含有CH3-C6H4-OOCH(-C6H4-为苯环)的结构,有邻、间、对三种同分异构体或C6H5-OOCCH3或C6H5-COOCH3,
所以满足条件的有机物总共5种,
故选B.
点评 本题考查了同分异构体的书写,题目难度不大,明确同分异构体的书写原则为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及逻辑推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛在LiAlH4的作用下生成乙醇,LiAlH4作还原剂 | |
| B. | LiH中两种微粒半径:H->Li+ | |
| C. | 1mol LiAlH4在125℃完全分解,则转移4mol电子 | |
| D. | LiH溶于水的化学反应方程式:LiH+H2O═LiOH+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com