
| A. | 酸的水溶液呈酸性,故酸性水溶液一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 工业上通过电解熔融MgCl2来制取金属镁;也可以通过电解熔融AlCl3来制取金属铝 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
分析 A.强酸弱碱盐的水溶液呈酸性;
B.Pb的化合价为+2价、+4价,不存在+3价;
C.氯化铝为共价化合物,不导电;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.氯化铵为强酸弱碱盐,水解呈酸性,不是酸的水溶液,故A错误;
B.Pb的化合价为+2价、+4价,不存在+3价,Pb3O4可表示为2PbO•PbO2,故B错误;
C.氯化铝为共价化合物,熔融状态下不导电,应用电解熔融的氧化铝的方法冶炼铝,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强稳定性顺序HF>H2O>NH3、HCl>H2S>PH3,推论正确,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重考查学生的分析能力和元素化合物知识的综合理解和运用,注意把握物质的性质的相似性和差异性,要结合物质的性质来分析移动,易错选项是C,注意氯化铝为共价化合物的特点,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
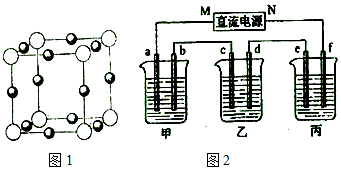
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径R>W>Y>Z | |
| B. | 气态氢化物稳定性:HmW<HnR | |
| C. | Z2Y2电子式可表示为  | |
| D. | RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
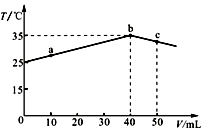
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | b点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.23×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CH2C12含极性共价键数目为2NA | |
| B. | 含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目大于NA | |
| C. | 4.6g甲苯(C7H8)和丙三醇(C3H8O3)混合物中含H原子数目为0.4NA | |
| D. | 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属钠投入MgCl2溶液中:2Na+Mg2+═2Na++Mg | |
| C. | 0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓ | |
| D. | 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com