
分析 Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,则Z为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素,Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,其原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,据此解答.
解答 解:Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,则Z为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素,Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,其原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素.
(1)Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,Cu原子失去4s能级的1个电子及3d能级中的1个电子形成Cu2+,Cu2+的核外电子排布式是1s22s22p63s23p63d9,故答案为:1s22s22p63s23p63d9;
(2)Q形成的最简单气态氢化物甲为CH4,Y形成的最简单气态氢化物乙为SiH4,非金属性C>Si,故稳定性CH4>SiH4,故答案为:a;
(3)同周期自左而右第一电离能增大趋势,同主族自上而下第一电离能降低,故第一电离能Si<C<N,故答案为:Si<C<N;
(4)非金属性越强,电负性越大,Cu为金属元素,非金属性Si<C<N<O,故电负性最大元素是O元素,故答案为:O.
点评 本题考查结构性质位置关系应用,涉及核外电子排布规律、电离能、电负性、元素周期律应用等,注意理解掌握同主族第一电离能异常情况.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:填空题
 的合成路线如图(部分反应条件省略)
的合成路线如图(部分反应条件省略)
 (注明反应的条件).
(注明反应的条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C$\stackrel{←}{=}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 4.2g | C. | 5.6 g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
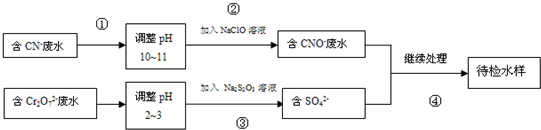
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mol | B. | 0.1mol | C. | 1mol | D. | 100mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 据英国媒体报道,某品牌牙膏中含有的消毒剂三氯生,遇到含氯的自来水时能生成哥罗芳(三氯甲烷),哥罗芳能引发肝病甚至致癌.已知三氯生的结构简式如图所示,下列有关说法不正确的是( )
据英国媒体报道,某品牌牙膏中含有的消毒剂三氯生,遇到含氯的自来水时能生成哥罗芳(三氯甲烷),哥罗芳能引发肝病甚至致癌.已知三氯生的结构简式如图所示,下列有关说法不正确的是( )| A. | 三氯生的分子式:C12H7Cl3O2 | B. | 哥罗芳属于烃类 | ||
| C. | 三氯生属于芳香族化合物 | D. | 哥罗芳不易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com