
| A、4.32 g |
| B、4.68 g |
| C、5.36 g |
| D、6.38 g |
| 0.896L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、8:1 |
| B、16:207 |
| C、71:2 |
| D、108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.0g |
| B、12.8g |
| C、14.4g |
| D、15.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12 | B、5.34 |
| C、7.26 | D、8.23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X一定大于Y |
| B、X可能等于Y |
| C、X可能小于Y |
| D、X可能大于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H8和C3H6 |
| B、C2H6和C3H6 |
| C、C2H4和C4H8 |
| D、CH4和C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 微型纽扣电池在现代生活中有广泛的应用,银锌电池为其中一种,其电极为Ag2O和Zn,KOH溶液为电解质,电极反应为:Zn+2OH=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH.
微型纽扣电池在现代生活中有广泛的应用,银锌电池为其中一种,其电极为Ag2O和Zn,KOH溶液为电解质,电极反应为:Zn+2OH=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH.查看答案和解析>>
科目:高中化学 来源: 题型:
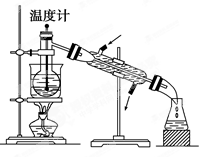 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图:
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图: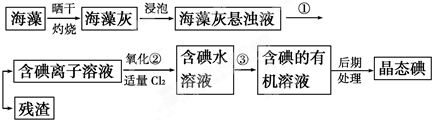
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某反应2A (g)+B(g)═3C(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com