
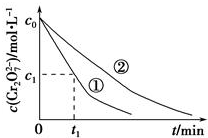
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
分析 (1)①②中PH不同,是探究PH对速率的影响;则②③是探究不同浓度时草酸对速率的影响;
(2)草酸中碳元素化合价为+3价,被氧化为+4价,Cr2O72-转化为Cr3+,根据电子守恒来计算;
(3)实验①②表明溶液pH越小,反应的速率越快,根据公式求算;
(4)根据铁明矾的组成分析;
(5)做对比实验:要证明Fe2+起催化作用,需做对比实验,再做没有Fe2+存在时的实验,用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验.
解答 解:(1)①②中PH不同,是探究PH对速率的影响;则②③是探究不同浓度时草酸对速率的影响,控制溶液总体积为100mL,则实验③草酸溶液体积为20mL,
故答案为:
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水 体积/mL |
| ① | ||||
| ② | ||||
| ③ | 20 |
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
点评 本题考查了探究重铬酸根与草酸反应过程中的催化作用,该反应为一比较熟悉的反应,还考查了从图象中获取数据并分析的能力、设计实验的能力等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乳酸是一种纯净物 | B. | 其聚合方式与聚苯乙烯相似 | ||
| C. | 其单体为 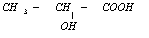 | D. | 聚乳酸是一种线型高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子是高度对称的平面形分子 | |
| B. | 苯与溴水混合无明显现象 | |
| C. | 苯不与酸性KMnO4溶液反应 | |
| D. | 1 mol C6H6在一条件下可与3 mol Cl2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O
+H2O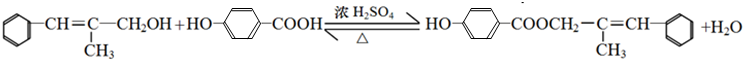
 .
.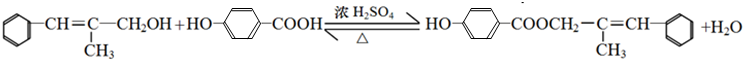
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
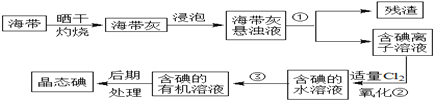
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
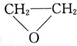
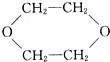
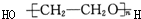
| A. | 只有① | B. | ②③ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应是放热反应 | |
| B. | 要加热或高温才能进行的化学反应一定是吸热反应 | |
| C. | 物质发生化学反应一定要有新物质生成但不一定要伴随着能量变化 | |
| D. | 旧的化学键断裂会释放出能量,而要生成新化学键要吸收能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com