
分析 (1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀,据此选择需要仪器;
(2)依据配制溶液一般步骤排序;
(3)①依据溶液稀释过程中溶质的物质的量不变计算;
②依据浓硫酸体积选择量筒规格;量取时发现量筒不干净,用水洗净后直接量取,导致量取的浓硫酸含有硫酸的物质的量偏小,依据C=$\frac{n}{V}$进行误差分析;
③依据溶液稀释规律:稀释过程中溶质的物质的量不变计算稀释后硫酸的物质的量浓度,结合硫酸为强电解质,1mol硫酸电离产生2mol氢离子计算氢离子物质的量浓度.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀,用到的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
故答案为:①量筒,②烧杯,③玻璃棒,④容量瓶,⑤胶头滴管;
(2)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:AEFDCB;
故答案为:AEFDCB;
(3)①设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=500mL×0.5mol/L,解得V=13.6mL;
故答案为:13.6mL;
②量取13.6mL浓硫酸应选择15mL量筒;量取时发现量筒不干净,用水洗净后直接量取,导致量取的浓硫酸含有硫酸的物质的量偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏低;
故答案为:15,偏低;
③设稀释后硫酸物质的量浓度为C,则依据稀释规律得:C×500mL=0.5mol/L×100mL,解得C=0.1mol/L,则氢离子物质的量浓度为:0.1mol/L×2=0.2mol/L;
故答案为:0.2mol/L.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| B. | 含金属元素的离子一定是阳离子 | |
| C. | 金属单质只有还原性,金属阳离子不一定只有氧化性 | |
| D. | 不同的气体,若体积不同,则它们所含的分子数一定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
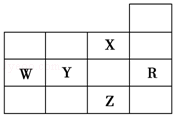 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | W元素的电负性大于Y元素的电负性 | |
| B. | X元素是电负性最大的元素 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | Y、Z的阴离子电子层结构都与R原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com