
| m |
| M |
| 0.042g |
| 12g/mol |
| 250 |
| 25 |
| 16.8g×5% |
| 40g/mol |
| 0.0015mol |
| 0.01L |
| 3.584L |
| 22.4L/mol |
| 0.7mol-0.16mol |
| 2 |
|
| 0.02mol×89g/mol |
| 0.02mol×89g/mol+0.25mol×56g/mol+2.02g |


科目:高中化学 来源: 题型:
| A、标准状况下C2H4气体22.4L,所含电子数为16NA |
| B、0.1mol铁在纯氧中充分燃烧,失电子数为0.3NA |
| C、1L 0.2mol/L的氯化铁溶液中,氯离子数为0.6NA |
| D、室温下,16g甲烷含有共价键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了降低成本,用工业酒精来兑酒 |
| B、油脂水解可制得肥皂 |
| C、使用太阳能等代替化石燃料,符合低碳节能减排的要求 |
| D、棉花与合成纤维的主要成分均为纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究元素及其化合物的反应有重要意义.
运用化学反应原理研究元素及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
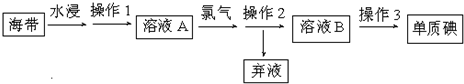
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3+ |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉溶液后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管Ⅰ中加入 | 无现象 | 灼烧后碘元素不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入 | 灼烧后碘元素以I-形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com