
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| H+ |
| 转换 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
| 10 |
| 11 |
| A、若用绿矾(FeSO4?7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| B、溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| C、常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水,阳极反应式一定为:2Cl--2e-=Cl2↑ |
| B、无论是原电池还是电解池中,电子均不能通过电解质溶液 |
| C、电解精炼铜时,粗铜作阴极 |
| D、为保护地下钢管不受腐蚀,可使它与铜板相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加成-消去-取代 |
| B、消去-加成-取代 |
| C、取代-消去-加成 |
| D、取代-加成-消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
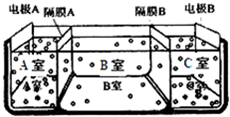 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
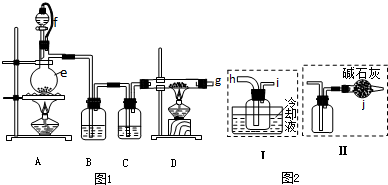
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
| 方案 | 不足之处 |
| 甲 | |
| 乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com