
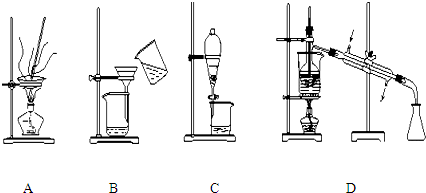
分析 (1)①可用蒸发的方法提出氯化钠;
②汽油和水互不相溶;
③乙醇和苯酚的沸点不同;
④泥沙不溶于水.
(2)过滤时应用玻璃棒引流;温度计位置和水的进出方向错误.
解答 解:(1)①水易挥发,可用蒸发的方法提出氯化钠,故答案为:A;
②汽油和水互不相溶,可用分液的方法分离,故答案为:C;
③乙醇和苯酚的沸点不同,可用蒸馏的方法分离,故答案为:D;
④泥沙不溶于水,可用过滤的方法分离,故答案为:B.
(2)过滤时为防止滤液流出,应用玻璃棒引流;蒸馏时温度计水银球应置于蒸馏烧瓶支管口附近,为充分冷凝,冷凝水应下进上出.
故答案为:用玻璃棒引流;温度计水银球应置于蒸馏烧瓶支管口附近、冷凝水应下进上出.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法选择等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g H2O中含有的原子总数为3NA | |
| B. | 在标准状况下,22.4L苯的物质的量为1mol | |
| C. | 1mol/L NaOH溶液中含有的Na+数为NA | |
| D. | 22gCO2与标准状况下11.2LHCI所含的分子数不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水鉴别SO2和CO2 | |
| B. | 用KSCN溶液鉴别FeCl2和FeCl3溶液 | |
| C. | 用焰色反应鉴别NaCl溶液和KCl溶液 | |
| D. | 用过量的NaOH溶液鉴别AlCl3溶液和MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释到100L | B. | 与0.1L pH=11的碱溶液混合 | ||
| C. | 加入一定量酸 | D. | 加入一定量碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
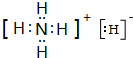 该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2
该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com