
【题目】完成下列反应化学方程式:
(1)用氯乙烯制聚氯乙烯;
(2)湿法炼铜;
(3)用CO还原赤铁矿(Fe2O3)冶炼铁;
(4)用铝矾土(Al2O3)冶炼铝;
(5)丁烷裂解获得乙烯 .
【答案】
(1)nCH2=CHCl ![]()
![]()
(2)Fe+CuSO4=FeSO4+Cu
(3)3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
(4)2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
(5)C4H10(g) ![]() C2H4+C2H6
C2H4+C2H6
【解析】解:(1)氯乙烯含有碳碳双键,发生加聚反应,生成聚氯乙烯化学方程式:nCH2=CHCl ![]()
![]() ,
,
所以答案是:nCH2=CHCl ![]()
![]() ;(2)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu,
;(2)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu,
所以答案是:Fe+CuSO4=FeSO4+Cu;(3)一氧化碳具有还原性,一氧化碳可以还原氧化铁生成铁和二氧化碳,化学方程为:3CO+Fe2O3 ![]() 3CO2+2Fe;
3CO2+2Fe;
所以答案是:3CO+Fe2O3 ![]() 3CO2+2Fe;(4)用铝矾土(Al2O3)冶炼铝:电解熔融氧化铝可以获得铝和氧气,反应的化学方程式为:2Al2O3
3CO2+2Fe;(4)用铝矾土(Al2O3)冶炼铝:电解熔融氧化铝可以获得铝和氧气,反应的化学方程式为:2Al2O3 ![]() 4Al+3O2↑,
4Al+3O2↑,
所以答案是:2Al2O3 ![]() 4Al+3O2↑;(5)丁烷在一定条件下裂解生成乙烯、乙烷,反应方程式为:C4H10(g)
4Al+3O2↑;(5)丁烷在一定条件下裂解生成乙烯、乙烷,反应方程式为:C4H10(g) ![]() C2H4+C2H6,
C2H4+C2H6,
所以答案是:C4H10(g) ![]() C2H4+C2H6.
C2H4+C2H6.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl﹣四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体. 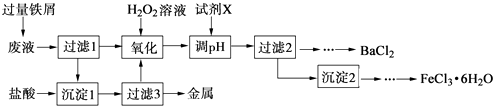
(1)沉淀1中含有的金属单质是 .
(2)氧化时加入H2O2溶液发生反应的离子方程式为 .
(3)下列物质中,可以作为试剂X的是(填字母).
A.BaCl2
B.BaCO3
C.NaOH
D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是 .
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 .
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为、冷却结晶、、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能通过置换反应得到金属铁的是
A. Na与FeSO4溶液常温混合 B. CO通过灼热的Fe2O3
C. H2通入FeSO4溶液 D. Al和Fe3O4混合加热至高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,可表明反应:A(g)+B(g)![]() C(g)+D(g) 已达化学平衡状态的是( )
C(g)+D(g) 已达化学平衡状态的是( )
A. 混合气体的压强 B. B的物质的量浓度 C. 混合气体的密度 D. v(A)正 = v(D)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行着广泛研究。请回答:
(1)某课题组实现了在常温常压下,以氮气和液态水为原料制备氨气,同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(g) | H2O(l) |
△H /kJ·mol-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为能化剂,据图示判断,负极反应的催化剂为______(填“Q”或“R”);正极的电极反应式为_________________________________________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)△H=-1266kJ/mol
2N2(g)+6H2O(g)△H=-1266kJ/mol
将固定比例NH3和O2 的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
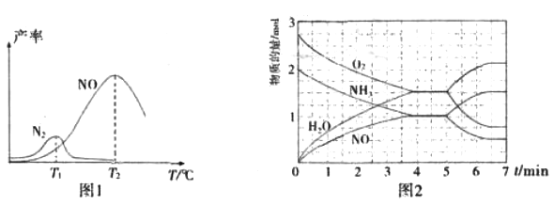
①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____________________________________。
③高于T2℃时,NO的产率降低的可能原因为______________(填选项字母)
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充人2molNH3和2.75molO2,发生反应
I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。
T2℃时,该反应的平衡常数K=________________;5min时,改变了某一外界条件,所改变的条件可能为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)![]() xC(g),若经2s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6mol/L。现有下列几种说法:①2s内用物质A表示的平均反应速率为0.3 mol/(L·s);②2s内用物质B表示的平均反应速率为0.6 mol/(L·s);③2s时物质B的转化率为70%;④x=2。其中正确的是( )
xC(g),若经2s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6mol/L。现有下列几种说法:①2s内用物质A表示的平均反应速率为0.3 mol/(L·s);②2s内用物质B表示的平均反应速率为0.6 mol/(L·s);③2s时物质B的转化率为70%;④x=2。其中正确的是( )
A. ①③ B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | CaO | MnO | MgO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2-)为_____nm,r(Ca2+)为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法不正确的是
A. 乙醇与乙酸都可以与钠反应
B. 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯
C. 1mol有机物 一定条件下能和6molNaOH反应
一定条件下能和6molNaOH反应
D. 分于式为C4H7ClO2,可与NaHCO3溶液反应产生CO2的有机物可能结构有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-过氧化氢燃料电池具有比能量高。安全方便等优点。其结构示意图如图所示、关于该电池的叙述正确的是
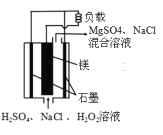
A. 该电池能在高温下正常工作
B. 电流工作时, H+向 Mg 电极移动
C. 电池工作时,正极周围溶液的pH将不断变小
D. 该电池的总反应式为: 该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com