
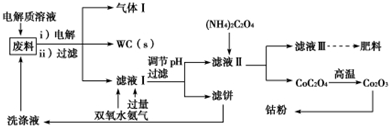
分析 某器具含碳化钨(WC)、金属钴(Co)及杂质铁等成分,用盐酸作电解质,阳极是铁与钴发生氧化反应,阴极是氢离子放电生成氢气,提到含氯化铵、氯化亚钴和氯化亚铁的混合体系,加入过氧化氢将亚铁氧化成铁离子,然后充入氨气调节溶液的PH使铁离子沉淀完全,所以滤饼的主要成分是氢氧化铁,向滤液中加入草酸铵使溶液中的钴离子完全沉淀,然后高温加热草酸钴得到单质钴,
(1)阳极发生氧化反应,活泼金属铁和钴失电子;
(2)图中的肥料为氯化铵;加入双氧水的目的是将亚铁氧化成易沉淀的铁离子;
(3)向滤液Ⅱ中加入草酸铵[(NH4)2C2O4]是草酸根离子与钴离子发生复分解反应,生成难溶的草酸钴;
(4)焙烧草酸钴(CoC2O4)分解是自身的氧化还原反应,根据得失电子守恒,化学方程式是:2CoC2O4$\frac{\underline{\;高温\;}}{\;}$Co2O3+3CO↑+CO2↑;
(5)将洗涤液回收配成电解液,目的是提高钴离子的利用率;滤饼的主要成分是氢氧化铁;
(6)单质钴放电说明单质铁已放电完全,所以铁全部转化为滤饼中的铁,根据铁守恒分析解答.
解答 解:(1)阳极发生氧化反应,活泼金属铁和钴失电子,电极反应式为:Co-2e-=Co2+、Fe-2e-=Fe2+,故答案为:Co-2e-=Co2+、Fe-2e-=Fe2+;
(2)图中的肥料为氯化铵;加入双氧水的目的是将亚铁氧化成易沉淀的铁离子,故答案为:氯化铵(NH4Cl);将Fe2+氧化成Fe3+;
(3)向滤液Ⅱ中加入草酸铵[(NH4)2C2O4]是草酸根离子与钴离子发生复分解反应,生成难溶的草酸钴,发生反应的离子方程式为Co2++C2O4 2-=CoC2O4↓,故答案为:Co2++C2O4 2-=CoC2O4↓;
(4)焙烧草酸钴(CoC2O4)分解是自身的氧化还原反应,根据得失电子守恒,化学方程式是:2CoC2O4$\frac{\underline{\;高温\;}}{\;}$Co2O3+3CO↑+CO2↑,故答案为:2CoC2O4$\frac{\underline{\;高温\;}}{\;}$Co2O3+3CO↑+CO2↑;
(5)将洗涤液回收配成电解液,目的是提高钴离子的利用率;滤饼的主要成分是氢氧化铁,故答案为:回收利用钴; Fe(OH)3;
(6)单质钴放电说明单质铁已放电完全,所以铁全部转化为滤饼中的铁,将所得滤饼洗涤干净后焙烧得到固体80g,所以氧化铁为80g,物质的量为:0.5mol,则杂质铁的质量分数为:$\frac{0.5×2×56}{1000000}×100%$=0.0056%,故答案为:0.0056%.
点评 本题考查了物质的分离提纯方法和操作的综合应用,考查氧化还原反应、离子反应、关系式计算等,题目难度中等,解答关键根据实验流程利用氧化还原反应判断发生的离子反应,侧重对学生综合能力的考查,是一道质量较好的能力考查题.


科目:高中化学 来源: 题型:选择题
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) | |
| B. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| C. | 反应进行到1 s时,v(A)=v(B) | |
| D. | 该反应的化学方程式为6A+2D?3B+4C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构 | |
| B. | 高聚物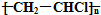 的单体可以通过乙烯和HCl加成制得 的单体可以通过乙烯和HCl加成制得 | |
| C. | (CH3)2CH-CH=CH-C(CH3)3与氢气加成后的产物用系统命名法命名为2,2,5-三甲基己烷 | |
| D. | 完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 1 mol 榄香烯最多能和6 mol H2反应 | |
| D. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的分子模型示意图: | B. | 某R元素原子的电子排布图: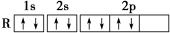 | ||
| C. | p-p π键电子云模型: | D. | 乙烯分子的球棍模型: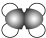 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A2)=0.4 mol•L-1•s-1 | B. | υ(B2)=0.8 mol•L-1•s-1 | ||
| C. | υ(C)=0.6 mol•L-1•s-1 | D. | υ(D)=0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④ | C. | ④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
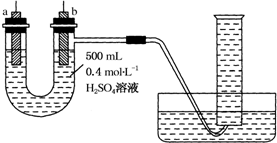 实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
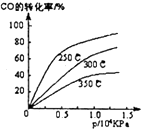 工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:
工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com