
| A. | 1mol稀硫酸和1mol稀Ba(OH)2溶液完全中和所放出的热量为中和热 | |
| B. | 中和反应都是放热反应,盐类水解反应都是吸热反应 | |
| C. | 在101kPa时,1mol碳燃烧所放出的热量一定是碳的燃烧热 | |
| D. | 碳与二氧化碳的反应既是吸热反应,也是化合反应 |
分析 A.中和热是指强酸、强碱生成1mol水放出的热量,1mol稀硫酸和1molBa(OH)2反应生成2mol水,且SO42-和Ba2+反应生成BaSO4,需要放出热量;
B.酸碱中和反应是放热反应;盐的水解为中和反应的逆反应,属于吸热反应;
C.燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量;
D.碳与二氧化碳的反应是吸热反应,结合化合反应概念判断反应类型.
解答 解:A.1 mol 硫酸与1mol Ba(OH)2 完全中和生成硫酸钡沉淀和2molH2O,同时SO42-和Ba2+反应生成BaSO4,需要放出热量,所以该反应放出的热量不是中和热,故A错误;
B.酸碱中和反应是放热反应,盐类水解反应是中和反应的逆反应为吸热反应,中和反应都是放热反应,盐类水解反应都是吸热反应,故B正确;
C.101kPa时,1mol碳燃烧若没有生成稳定的氧化物即生成CO所放出的热量就不是碳的燃烧热,故C错误;
D.碳与二氧化碳生成CO的反应是吸热反应,该反应也属于化合反应,故D正确;
故选AC.
点评 本题考查反应热与焓变的应用,题目难度不大,涉及中和热和燃烧热的概念、反应类型判断等知识,明确化学反应与能力变化的关系即可解答,试题培养了学生的灵活应用能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
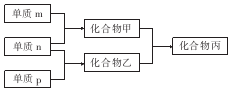 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )| A. | X是同周期中非金属性最强的元素 | |
| B. | 元素X、Y、Z的原子半径大小关系为X<Y<Z | |
| C. | Z的氧化物的水化物的酸性在主族元素中最强 | |
| D. | 化合物丙是离子化合物,既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:4:7 | B. | 4:2:7 | C. | 7:4:2 | D. | 3:5:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
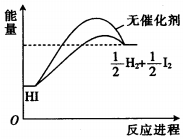
| A. | 加入催化剂,减小了反应的活化能 | |
| B. | 加入催化剂,可提高HI的平衡转化率 | |
| C. | 降低温度,HI的分解速率加快 | |
| D. | 反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体可用于净水 | B. | Fe2O3可用作红色涂料 | ||
| C. | 纯碱溶液可用于去除油污 | D. | MnO2和浓HCl可用于工业制氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com