
有一瓶无色澄清的溶液,可能由以下离子中的几种组成:SO32-、I-、CO32-、Cl-、SO42-、Fe2+、Na+、MnO4-,请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B。
步骤二:往B中加入足量BaCl2溶液,得白色沉淀和溶液C。
步骤三:往C溶液中通入足量Cl2,得黄褐色溶液D。
(1)该溶液中一定存在的离子是: 。
(2)该溶液中可能存在的阴离子是: 。
(3)步骤三中溶液变黄褐色是因为生成了某种物质,确认该物质的实验操作与现象是:取适量D溶液于试管中, 。
科目:高中化学 来源: 题型:选择题
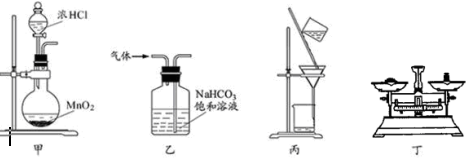
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙分离出MnCl2溶液中的固体MnO2 | |
| D. | 用装置丁称得回收的二氯化锰质量为5.36g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 23:12:9 | C. | 9:12:23 | D. | 36:69:92 |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:推断题
某芳香烃A,分子式为C8H10,B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物Y,以Y为单体可以合成高分子化合物。某烃类衍生物X,分子式为C15H14O3,遇FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系(无机物略去):

(1)一种属于芳香烃类的A的同分异构体,其苯环上的一氯代物仅有一种,其结构简式为 。
(2)J中所含的含氧官能团的名称为__________________。
(3)E与H反应的化学方程式是_______________,反应类型是_____________。
(4)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式:_________________________。
① 与FeCl3溶液作用显紫色
② ②与新制Cu(OH)2悬浊液作用产生红色沉淀
③ ③苯环上的一卤代物有2种
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列说法正确的是
A.(CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种(不考虑顺反异构)
C.1mol有机物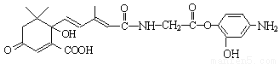 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH
D.1molβ-紫罗兰酮(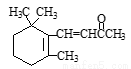 )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、 干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是

查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| N2 | NO2 | NO | HNO3 |
B | Na | Na2O2 | NaOH | NaCl | |
C | Si | SiO2 | H2SiO3 | Na2SiO3 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
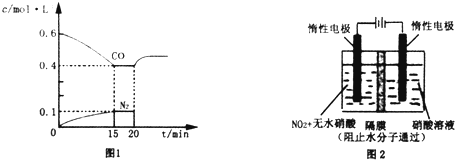
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com