
分析 (1)若该溶液中只含有一种溶质,为CH3COONa,溶液中醋酸根离子水解溶液显碱性;
(2)若该溶液呈酸性,则溶液中的溶质CH3COOH,CH3COONa,醋酸电离大于醋酸根离子的水解溶液显酸性;
(3)无色溶液中只含有包括Na+、H+、OH-、CH3COO-在内的四种离子,若溶液中含有两种溶质,且溶液呈碱性,则c(OH-)>c(H+),根据离子浓度关系和电离以及水解情况来回答.
解答 解:(1)若该溶液中只含有一种溶质,为CH3COONa,溶液中醋酸根离子水解溶液显碱性,反应的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(2)则溶液中的溶质CH3COOH,CH3COONa,醋酸电离大于醋酸根离子的水解溶液显酸性,所以溶质为:CH3COOH,CH3COONa,
故答案为:CH3COOH,CH3COONa;
(3)当该溶液中溶质为两种,且溶液呈碱性时,溶液中的溶质组成可以为:氢氧化钠和醋酸钠(较多),此时存在c(Na+)>c(CH3COO-)>c(OH->c(H+),还可以是氢氧化钠和醋酸钠(较少),c(Na+)>c(OH-)>c(CH3COO-)>c(H+),溶液中存在电荷守恒:c(OH-)
+c(CH3COO-)=c(H+)+c(Na+),c(OH-)>c(H+),则c(Na+)>c(CH3COO-),所以BC不可能出现,
故答案为:BC.
点评 本题考查离子浓度的大小比较以及弱电解质的电离等问题,题目难度中等,注意根据溶液离子浓度的关系结合弱电解质的电离和盐类的水解等知识解答.


科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
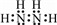 .
. ,N采用sp3杂化方式,粒子空间构型为V型.
,N采用sp3杂化方式,粒子空间构型为V型.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2升华 | B. | NaCl颗粒被粉碎 | ||
| C. | 溴蒸汽被木炭吸附 | D. | 从NH4HCO3中闻到了刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Al、Mg、K | B. | S、Cl、Cl-、S2- | C. | Na+、Na、Cl、Cl- | D. | Ca2+、K+、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
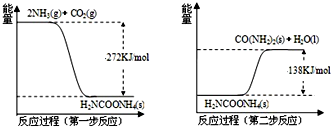
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用铝制容器盛装浓硫酸,说明常温下铝和浓硫酸不反应 | |
| B. | 在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si | |
| C. | 在空气中加热铝箔,发现内部的铝熔化但不滴落,说明铝不易与氧气反应 | |
| D. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫通入已酸化的硝酸钡溶液 | |
| B. | 二氧化氮通入氯化亚铁溶液中 | |
| C. | 氢氧化铝沉淀中滴加氨水 | |
| D. | 过量铜片与稀硝酸反应结束的溶液中加入稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com