
【题目】已知单质铜与稀硝酸的反应为3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2(Cu的相对原子质量为64)。现把19.2 g Cu放入200 mL 5 mol·L-1硝酸中,充分反应,问:
(1)哪种物质过量?______
(2)参加反应的硝酸的物质的量为多少?______
(3)在标准状况下产生的气体的体积为多少?______
(4)生成水的分子数为多少?______
(5)若反应前后溶液的体积不变,则生成Cu(NO3)2的物质的量浓度为多少?______
【答案】硝酸 0.8 mol 4.48 L 2.408×1023 1.5 mol·L-1
【解析】
n(Cu)=n(Cu)=![]() =0.3 mol,可根据反应的化学方程式计算消耗或生成物质的物质的量。
=0.3 mol,可根据反应的化学方程式计算消耗或生成物质的物质的量。
存在过量问题时,以不足量的物质为准进行计算。计算时,要注意“单位纵相同;数据横相应”,用已知数据,可直接求出未知量。
(1)方法一:假设法
3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2
因为![]() =
=![]()
解得n(HNO3)=0.8 mol
HNO3实际为5 mol·L-1×0.2 L=1 mol,
0.8<1(实际量),所以HNO3过量。
方法二:物质的量比值法
n(Cu)=![]() =0.3 mol
=0.3 mol
n(HNO3)=5 mol·L-1×0.2 L=1 mol
所以有![]() <
<![]() ,故HNO3过量。计算时,应以Cu的数据为准。
,故HNO3过量。计算时,应以Cu的数据为准。
(2)3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2
![]() =
=![]() ,解得n(HNO3)=0.8 mol。
,解得n(HNO3)=0.8 mol。
(3)3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2
![]() =
=![]() ,解得V(NO)=4.48 L。
,解得V(NO)=4.48 L。
(4)3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2
![]() =
=![]() ,
,
解得N(H2O)=2.408×1023。
(5)物质的量浓度c与方程式不成比例,必须把它与体积V相乘转化为物质的量(n=cV),才能代入方程式计算。
3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2
![]() =
=![]()
解得c[Cu(NO3)2]=1.5 mol·L-1。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】t℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:![]() ,
,![]() ,
,![]() 。
。
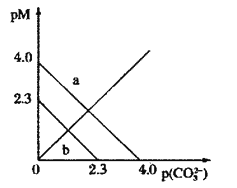
下列说法正确的是( )
A.线a表示YCO3的溶解平衡曲线
B.![]()
C.t℃时,向XCO3悬浊液中加入饱和![]() 溶液,可能有YCO3生成
溶液,可能有YCO3生成
D.t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知六种物质:①H2O ②氨水③ Mg ④ HNO3 ⑤Ba(OH)2 ⑥CuSO4·5H2O
根据上述提供的物质,回答下列问题:
(1)属于电解质的是________(填序号,下同)。
(2)上述物质中④与⑤反应的离子方程式为_________。
(3)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为________g。在配制过程中,若其它操作均正确,则下列操作会使所配溶液物质的量浓度偏低的是_________(填字母序号)。
A 溶解后小烧杯、玻璃棒没有洗涤
B 所用容量瓶中,已有少量蒸馏水
C 定容摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
D 定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时,5v正(O2)=4v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

①漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式______,____。
②某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448 mL气体,则该漂白粉中所含有效成份的质量为_____________(假设漂白粉中的其它成份不与硝酸反应)。
(2)将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:原混合物中Na2O的质量为______g,所得溶液的物质的量浓度为______ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的说法正确的是
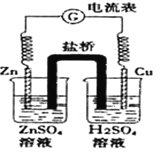
A. 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降
B. 盐桥的作用是让电子通过,以构成闭合回路
C. 随着反应进行,右烧杯中溶液pH变小
D. 总反应为:2H++ Zn ="==" H2↑+ Zn2+△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()

可能用到的有关数据如下:

Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向NaAlO2溶液中通入过量CO2:![]()
B.铝与氯化铜溶液反应:![]()
C.次氯酸钙溶液中通入SO2气体:![]()
D.在溶液中NH4HCO3与NaOH以等物质的量混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
B.CH4和P4都是正四面体结构,物质的量相同的CH4和P4的共价键数之比为![]()
C.标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D.常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com