

分析 (1)Mn位于周期表中第4周期,VIIB族,其核外电子排布式为1s22s22p63s23p63d54s2(或[Ar]3d54s2),d轨道上电子数为5,5个d电子分占5个g轨道时,能量较低;
(2)MnO的熔点(1650℃)比MnS的熔点(1610℃)高,二者熔点较高,应为离子晶体,离子晶体晶格能越大,熔点越高;
(3)①与Mn2+形成配位键的配体应为THF,即四氢呋喃,为有机配体,在四氢呋喃中,O原子上存在孤电子对,Mn2+提供空轨道,二者形成配位键;
②根据VSEPR理论和杂化轨道理论判断BH4-的空间构型和中心B原子的杂化轨道类型;
③求等电子体常采用的方法是上下左右平移元素,同时调电子数来确定,需保证原子个数相同;
(4)①根据晶胞图,晶胞中A原子的原子坐标为(0,0,0),为坐标原点,根据建立的空间直角坐标系,C原子位于立方晶胞体心,根据立体几何知识求出C原子的原子坐标;
②Mn在晶胞中均处于面心,据此判断Mn在晶体中的堆积方式;
③根据晶体密度公式ρ=$\frac{z{M}_{r}}{{N}_{A}V}$计算,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积.
解答 解:(1)Mn位于周期表中第4周期,VIIB族,其核外电子排布式为1s22s22p63s23p63d54s2(或[Ar]3d54s2),d轨道上电子数为5,5个d电子分占5个g轨道时,能量较低,则d轨道中未成对电子数为5,
故答案为:1s22s22p63s23p63d54s2(或[Ar]3d54s2);5;
(2)MnO的熔点(1650℃)比MnS的熔点(1610℃)高,二者熔点较高,应为离子晶体,离子晶体晶格能越大,熔点越高,则MnO熔点较高的原因是:MnO的晶格能大,
故答案为:离子;MnO的晶格能大;
(3)①与Mn2+形成配位键的配体应为THF,即四氢呋喃,为有机配体,在四氢呋喃中,O原子上存在孤电子对,Mn2+提供空轨道,二者形成配位键,则与Mn2+形成配位键的原子为O,
故答案为:O;
②对于BH4-,根据VSEPR理论,中心B原子的配位原子数为BP=4,孤电子对数为LP=$\frac{3-1×4+1}{2}$=0,则其价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,中心B原子的杂化类型为sp3,粒子空间构型为正四面体,
故答案为:正四面体;sp3;
③等电子体是指原子数目相同,价电子数目也相同的粒子,则与BH4-互为等电子体的分子或离子有CH4(SiH4或NH4+),
故答案为:CH4(SiH4或NH4+);
(4)①根据晶胞图,晶胞中A原子的原子坐标为(0,0,0),为坐标原点,根据建立的空间直角坐标系,C原子位于立方晶胞体心,根据立体几何知识不难求出C原子的原子坐标为($\frac{1}{2}$,$\frac{1}{2}$,$\frac{1}{2}$),
故答案为:($\frac{1}{2}$,$\frac{1}{2}$,$\frac{1}{2}$);
②Mn在晶胞中均处于面心,则Mn在晶体中的堆积方式为面心立方最密堆积,
故答案为:面心立方最密;
③取1mol晶胞,则含有NA个晶胞,立方晶胞中,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,晶胞内部粒子为整个晶胞所有,则一个晶胞中,C原子数目为1,Mn原子数目为$6×\frac{1}{2}$=3,Sn原子数目为$8×\frac{1}{8}$=1,则1mol晶胞的质量为m=1×12+3×55+1×119=296g,一个晶胞的体积为V0=a3pm3=a3×10-30cm3,则晶体的密度为$ρ=\frac{m}{{N}_{A}缺{V}_{0}}$=$\frac{296}{{N}_{A}×(a×1{0}^{-10})^{3}}$g/cm3,
故答案为:$\frac{296}{{N}_{A}×(a×1{0}^{-10})^{3}}$g/cm3.
点评 本题主要考察物质结构知识,包含核外电子排布式,晶格能的比较,配位键的形成,价层电子对互斥理论,杂化轨道理论,等电子体原理,原子坐标的书写,晶体密度的计算.题目涉及的知识点较多,对于原子坐标,记住“1”即“0”,本题难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
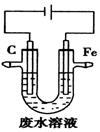
| A. | 石墨极上发生氧化反应 | |
| B. | 阳极的电极反应式为Fe-3e-=Fe3+ | |
| C. | 除去Cr2O72-的反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 随着电解的进行,石墨极附近电解质溶液的pH会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
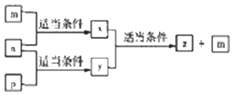 A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )| A. | D的单质起火燃烧时可用x作灭火剂 | |
| B. | 元素的非金属性:C>A>B | |
| C. | 原了半径:D>C>B>A | |
| D. | B与同族元素的氧化物可发生置换反应,并且做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为4.4g (假设该过程中所有液体进出口密闭) | |
| B. | b放电的电极反应式为SO32-+H2O-e-═SO42-+2H+ | |
| C. | 电子由a经内电路流向b电极 | |
| D. | 图中b极连接电源的正极,C 口流出的物质是亚硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉在稀酸作用下转化为葡萄糖 | |
| B. | 乙酸乙酯在氢氧化钠溶液中加热反应 | |
| C. | 葡萄糖在酒化酶作用下转化为乙醇和二氧化碳 | |
| D. | 蛋白质在一定条件下转化为氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素化合价为+2价 | |
| B. | H2O2在该反应中做还原剂 | |
| C. | NaCN中含有离子键和极性共价键 | |
| D. | 生成0.1 mol NH3时,有0.2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )
25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )| A. | 点 ①②之间一定为c(Na+)>c(CH3COOO-)>c(OH-)>c(H+) | |
| B. | 点 ③处有c(Na+)=c(CH3COOO-)+c(CH3COOH) | |
| C. | 点①②③④处水的电离程度由大到小的顺序额为 ②③④① | |
| D. | 点④处有c(H+)+c(CH3COOH)=2c(OH-)-c(CH3COOO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com