
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 常温常压下,1.6 g CH4含原子数为0.5NA | |
| D. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA |
分析 A.标准状况下气体摩尔体积为22.4L/mol;
B.分子总数为NA的N2、CO混合气体物质的量为1mol,温度和压强不知,不能计算体积;
C.物质的量n=$\frac{m}{M}$,甲烷分子中含5个原子;
D.物质的量n=$\frac{m}{M}$,钙最外层电子数2个,据此计算分析.
解答 解:A.标准状况下,水不是气体,22.4 L H2O含有分子数不是NA ,故A错误;
B.分子总数为NA的N2、CO混合气体物质的量为1mol,质量=1mol×28g/mol=28 g,温度压强不知不能计算气体体积,故B错误;
C.常温常压下,1.6 g CH4含物质的量=$\frac{1.6g}{16g/mol}$=0.1mol,原子数=0.1mol×5×NA=0.5NA,故C正确;
D.4 g金属钙物质的量=$\frac{4g}{40g/mol}$=0.1mol,钙最外层电子数2个变成钙离子时失去的电子数目为0.2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的应用,物质的量和微粒数的计算分析,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 该浓度的盐酸可以用广口瓶盛装 | |
| B. | 该试剂的物质的量浓度为11.9mol/L | |
| C. | 用该盐酸配制250毫升2.0摩尔、升的稀盐酸时需要选用100毫升量筒 | |
| D. | 该盐酸中所含Cl-数目为5.95NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )| A. | CuCl2 | B. | AlCl3 | C. | H2O2 | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: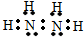 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
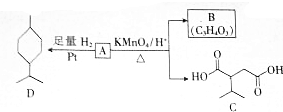
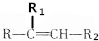 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$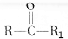 +R2COOH
+R2COOH .A与等物质的量的溴单质反应的产物有3种.
.A与等物质的量的溴单质反应的产物有3种. +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com