
【题目】碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g)![]() Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O![]() Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
【答案】(1) 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260kJ/mol (2)①四 ②0.018mol/(L·min) ③ bcd (3)0.06 (4)K1>K2>K3 acd
【解析】(1)①4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
②C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
③2FeCO3(s)=2Fe(s)+2C(s)+3O2(g)△H=+1480kJ/mol,
根据盖斯定律计算③×2+②×4+①得到FeCO3在空气中煅烧生成Fe2O3的热化学方程式:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=![]() ﹣260 kJ/mol;
﹣260 kJ/mol;
(2)①原子序数为26的铁元素位于元素周期表的第四周期(26-2-8-8=8,第四周期有18种元素);
②Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g)
1mol 6mol
![]() n
n
n=0.18mol
氢气表示的反应速率=![]() ;
;
③a.CH4的转化率等于CO的产率,都是代表正反应方向,故不能说明正逆反应速率相同,错误;b.反应前后气体质量增大一倍,气体体积增大两倍,当混合气体的平均相对分子质量不再改变是反应没达到平衡状态,正确;c.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v正(CO):v逆(H2)=1:2,说明反应达到平衡状态,正确;d.反应中氧化铁转化为铁固体质量减少,若固体总质量不变说明反应达到平衡状态,正确;答案为:bcd;
(3) FeO(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
开始时物质的量:0.04 x 0
改变的物质的量:0.02 x-0.02 0.02
平衡时物质的量:0.02 x-0.02 0.02
则:![]() ,解得:x=0.06;
,解得:x=0.06;
(4)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3;a.加水稀释,则水解平衡正向移动;b.加入氯化钠,氯化钠溶液为中性,平衡不移动;c.因为水解为吸热反应,所以升温,平衡正向移动;d.加入碳酸钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动。答案选acd。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关叙述正确的是
A .标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B.100ml 0.1mol/LCH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01NA
C.0.1mol CH4所含质子数为NA
D.0.5mol C2H4中含有的C=C双键数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中既能发生加成反应,又能发生酯化反应,还能被新制Cu(OH)2悬浊液氧化的物质是( )
A.CH2=CH-CHOB.CH3CH2COOH
C.CH2=CH-COOCH3D.CH2OH(CHOH)4CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的是
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.NH为正四面体结构,可推测PH 也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
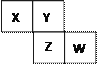
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是
A. X的最常见气态氢化物的水溶液显碱性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应剧烈
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法正确的是( )
A.Fe3O4俗称铁红,常做红色油漆和涂料
B.燃料电池的燃料都在负极发生氧化反应
C.“歼﹣20”飞机上使用的碳纤维是一种新型的有机高分子材料
D.工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )
A. 离子半径:Ca2+>Cl->S2-
B. 第一电离能:Si>C>N
C. 电负性:F>S>Mg
D. 热稳定性:SiH4>H2S>H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处处留心皆知识.生活中遇到下列问题,不涉及到化学变化的是( )
A.食物腐败变质
B.浓硫酸在空气中体积增大
C.铝表面形成致密的薄膜
D.食醋洗掉水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:

(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、
玻璃棒、托盘天平外,还必须用到的仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。
(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手
旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________________,
直到滴定终点。滴定达到终点的标志是:_______________________________。
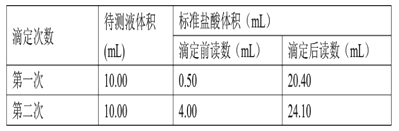
(4)根据下列数据,烧碱的纯度为:_______________________
(5)判断下列操作引起的误差(填偏大、偏小或无影响)
①滴定前读数正确,滴定终点读数时仰视_________________
②装待测液前,锥形瓶内残留少量蒸馏水_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com