铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl
2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:
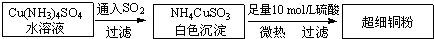
①[Cu(NH
3)
4]SO
4中所含的化学键有
.
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列说法正确的是
(填字母序号).
A.反应后溶液中不存在任何沉淀,所以反应前后Cu
2+的浓度不变
B.沉淀溶解后,将生成深蓝色的[Cu(NH
3)
4]
2+配离子
C.向反应后的溶液中加入乙醇,因为[Cu(NH
3)
4]
2+不与乙醇反应,故溶液不会发生变化
D.在[Cu(NH
3)
4]
2+中,NH
3分子中的氮原子给出孤电子对,Cu
2+有空轨道接受电子对
(2)氯化亚铜(CuCl)的制备过程是:向CuCl
2溶液中通入一定量SO
2,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为
.
(3)铜单质晶体中原子的堆积方式如图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如图丙所示.
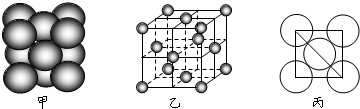
若已知铜的原子半径为d,N
A代表阿伏加德罗常数,铜的相对原子质量为M,请回答:
①晶胞中铜原子的配位数为
,一个晶胞中铜原子的数目为
;铜单质晶体中原子的堆积方式是
堆积.
②该晶体的密度为
(用字母表示).




 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
 的酸性废水,可利用微生物电池法除去,其原理如图2所示
的酸性废水,可利用微生物电池法除去,其原理如图2所示
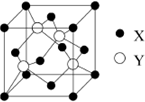 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
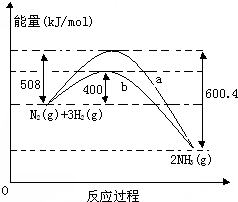 如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.
如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.