
 ��
��
 ��D
��D ��E
��E ��
�� ��
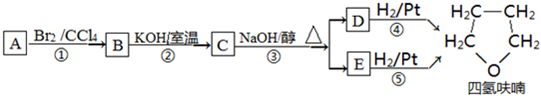
�� ���� YΪ����һԪ�����������ʽΪCnH2n+2O��������C����������Ϊ$\frac{12n}{12n+2n+2+16}$��100%=65%����n=4����Y�ķ���ʽΪC4H10O��1molA��1molH2ǡ�÷�Ӧ���ɱ���һԪ������A�ܺ�Br2/CCl4��Ӧ��˵��A�����к���C=C������A�л�����-OH������Ϣ±�����봼��Ӧ�����ѣ��������Ľṹ����֪AΪCH2=CHCH2CH2OH��A���巢���ӳɷ�Ӧ����B����BΪCH2BrCHBrCH2CH2OH��B����ȡ����Ӧ����C��CΪ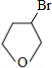 ��C������ȥ��Ӧ����D��E��D��EΪ
��C������ȥ��Ӧ����D��E��D��EΪ ��
��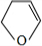 ���ݴ˷������
���ݴ˷������
��� �⣺YΪ����һԪ�����������ʽΪCnH2n+2O��������C����������Ϊ$\frac{12n}{12n+2n+2+16}$��100%=65%����n=4����Y�ķ���ʽΪC4H10O��1molA��1molH2ǡ�÷�Ӧ���ɱ���һԪ������A�ܺ�Br2/CCl4��Ӧ��˵��A�����к���C=C������A�л�����-OH������Ϣ±�����봼��Ӧ�����ѣ��������Ľṹ����֪AΪCH2=CHCH2CH2OH��A���巢���ӳɷ�Ӧ����B����BΪCH2BrCHBrCH2CH2OH��B����ȡ����Ӧ����C��CΪ ��C������ȥ��Ӧ����D��E��D��EΪ
��C������ȥ��Ӧ����D��E��D��EΪ ��
�� ��
��
��1��Y�ķ���ʽΪC4H10O��A�Ľṹ��ʽΪCH2=CHCH2CH2OH��A�й�����������̼̼˫���ʹ��ǻ���
�ʴ�Ϊ��C4H10O��̼̼˫���ʹ��ǻ���CH2=CHCH2CH2OH��
��2������������������A��Br2/CCl4 �����ӳɷ�Ӧ����B����B�ڼ��������·���ȡ����Ӧ������C����C��NaOH/����Һ�з�����ȥ��Ӧ����D��E����D��E���������������ӳɷ�Ӧ��������ૣ���ڢٲ���Ӧ����Ϊ�ӳɷ�Ӧ���ڢڲ���Ӧ����Ϊȡ����Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��ȡ����Ӧ��
��3����������������������BΪCH2BrCHBrCH2CH2OH������Br���ǻ����ֹ����ţ�Br�ܷ�����ȥ��Ӧ���ǻ��ܷ���������Ӧ��������Ӧ����ѡABC��
��4����������������C��D��E�Ľṹ��ʽ�ֱ�ΪC�� ��D
��D ��E��
��E�� ��
��
�ʴ�Ϊ�� ��
�� ��
�� ��
��
��5��������C��NaOHˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ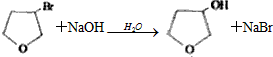 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л����ƶϣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������ƶϼ�֪ʶǨ���������������ʽṹ��ʽ��Ϸ�Ӧ�����������Ϣ�����ƶϣ���ȷ�ƶϸ����ʽṹ��ʽ�ǽⱾ��ؼ�����Ŀ�ѶȲ���


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | ���� | �����Լ���������� | |
| A�� | NaNO3 | CaCO3 | �ܽ⡢���ˡ����� |
| B�� | FeSO4 | CuSO4 | ����NaOH��Һ������ |
| C�� | NaCl��Һ | I2 | �Ӿƾ�����ȡ��Һ |
| D�� | KNO3��Һ | AgNO3 | ����NaCl��Һ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ��ƿ | C�� | ���� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
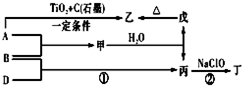 ��֪ A��B��DΪ��ѧ�����ĵ��ʣ��ס��ҡ�����������Ϊ������Ԫ����ɵĻ�������У�����һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壻����һ�ָ���ȼ�ϣ������Ԫ�������ͬ��1mol �������в�ͬԭ�ӵ���Ŀ��Ϊ1��2���Һ���18mol���ӣ�����һ��������ˮ�İ�ɫ��״���ʣ�������ǿ�ᷴӦ��Ҳ����ǿ�Ӧ�����о�ˮ���ã������ʼ��ת����ϵ��ͼ��ʾ��ijЩ��������ȥ����
��֪ A��B��DΪ��ѧ�����ĵ��ʣ��ס��ҡ�����������Ϊ������Ԫ����ɵĻ�������У�����һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壻����һ�ָ���ȼ�ϣ������Ԫ�������ͬ��1mol �������в�ͬԭ�ӵ���Ŀ��Ϊ1��2���Һ���18mol���ӣ�����һ��������ˮ�İ�ɫ��״���ʣ�������ǿ�ᷴӦ��Ҳ����ǿ�Ӧ�����о�ˮ���ã������ʼ��ת����ϵ��ͼ��ʾ��ijЩ��������ȥ���� ��д�����Ľṹʽ
��д�����Ľṹʽ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ȼ�̼ | B�� | �����屽 | C�� | ���ͺͱ� | D�� | �屽��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol Cl2�μӷ�Ӧ��ת�Ƶĵ�����һ��Ϊ2NA | |
| B�� | ���³�ѹ�£�23g NO2��N2O4�Ļ�������е�ԭ����Ϊ0.5NA | |
| C�� | ��״���£�22.4L��ϩ�к����Թ��ۼ���Ϊ4NA | |
| D�� | 2L 0.1mol•L-1��HClO��Һ�к��е�H+������С��0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȡ��Һ������ɫ��Ӧ�Ի�ɫ��һ������Na+ | |
| B�� | �μ�BaCl2��Һ��������ɫ������֤����SO42- | |
| C�� | �μ�KSCN��Һ����ΪѪ��ɫ����Һ�к�Fe2+ | |
| D�� | ����ϡ���������ɫ���壬һ������CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
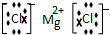 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com