
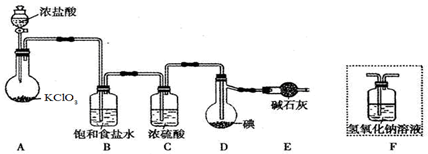
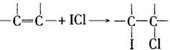
分析 由实验装置可知,A中氯酸钾具有氧化性能把浓盐酸氧化生成氯气,发生KClO3+6HCl=KCl+3Cl2↑+3H2O;浓盐酸易挥发生成的氯气中含有氯化氢,所以装置B中饱和食盐水的作用是除去氯气中的氯化氢,已知ICl易水解,若用装置F代替装置E,则装置F中的水蒸气会进入装置D中,使ICl水解,所以不能用装置F代替装置E;由于ICl与ICl3的沸点相差较大,因此若所制得的ICl中溶有少量ICl3杂质,提纯的方法是蒸馏,
(1)氯酸钾具有氧化性能把浓盐酸氧化生成氯气;
(2)制备的氯气中含有氯化氢,可以用饱和食盐水除去氯气中的氯化氢;装置F中的水蒸气进入装置D中,会使ICl水解;
(3)ICl与ICl3的沸点相差较大;
(4)①碘遇淀粉显蓝色;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,其物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,求出ICl的物质的量,
再根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量.
解答 解:(1)氯酸钾具有氧化性能把浓盐酸氧化生成氯气,则装置A中发生反应的化学方程式是KClO3+6HCl=KCl+3Cl2↑+3H2O;
故答案为:KClO3+6HCl=KCl+3Cl2↑+3H2O;
(2)浓盐酸易挥发生成的氯气中含有氯化氢,所以装置B中饱和食盐水的作用是除去氯气中的氯化氢,已知ICl易水解,若用装置F代替装置E,则装置F中的水蒸气会进入装置D中,使ICl水解,所以不能用装置F代替装置E;
故答案为:除去氯气中的氯化氢;装置F中的水蒸气会进入装置D中,使ICl水解;
(3)由于ICl与ICl3的沸点相差较大,因此若所制得的ICl中溶有少量ICl3杂质,提纯的方法是蒸馏,
故答案为:C;
(4)①由于碘遇淀粉显蓝色,因此滴定过程中可用淀粉溶液作指示剂,
故答案为:淀粉溶液;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应溶液就会褪色,从而导致消耗硫代硫酸钠的量减小,即会导致V1偏小;
故答案为:偏小;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,则Na2S2O3的物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,
所以ICl的物质的量是0.001a(V2-V1)mol×$\frac{1}{2}$,
由根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量为0.001a(V2-V1)mol×$\frac{1}{2}$×$\frac{100ml}{10ml}$=5a(V2-V1)×10-3mol,
故答案为:5a(V2-V1)×10-3.
点评 本题考查了物质制备实验方案设计,侧重于实验原理、基本操作、物质性质、数据处理等知识的考查,主要考查了学生的实验操作能力和数据处理能力,题目难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(E) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(E) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(T1)>K(T2) | |
| C. | T2温度下10min内,平均速率为v(E)=0.020mol•L-1•min-1 | |
| D. | T1温度下达到平衡后,再充入0.50mol E和1.0mol F,达到新平衡时E的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氟丙烷(C3F8)与全氟甲烷(CF4)互为同系物 | |
| B. | 石墨能导电,所以石墨属于电解质 | |
| C. | 在化学反应中,原子的种类和数目均保持不变 | |
| D. | 干冰的气化、煤的气化均属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
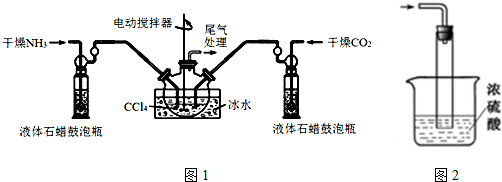
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
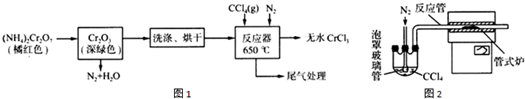
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
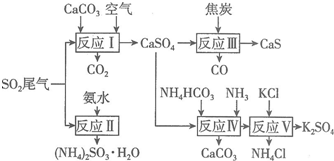
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Na+数目增多 | |
| B. | 溶液中有氢气逸出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液质量减少,溶质的质量分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:
A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com