
分析 (1)Fe与氯化铁反应生成氯化亚铁;
(2)HCl与饱和碳酸氢钠反应生成二氧化碳;
(3)氧化铝与盐酸反应,而二氧化硅不能.
解答 解:(1)Fe与氯化铁反应生成氯化亚铁,除杂试剂为铁,化学反应为Fe+2FeCl3=3FeCl2,故答案为:铁;Fe+2FeCl3=3FeCl2;
(2)HCl与饱和碳酸氢钠反应生成二氧化碳,除杂试剂为饱和的NaHCO3溶液,离子反应为HCO3-+H+=CO2↑+H2O,故答案为:饱和的NaHCO3溶液;HCO3-+H+=CO2↑+H2O;
(3)氧化铝与盐酸反应,而二氧化硅不能,除杂试剂为盐酸,化学反应为Al2O3+6HCl=2AlCl3+3H2O,故答案为:盐酸;Al2O3+6HCl=2AlCl3+3H2O.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ②⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.15 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.25 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | MnO4-、Cl-、SO42-、K+ | D. | SiO32-、SO32-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | NaOH溶液和CO2 | ||
| C. | Na2O2和CO2 | D. | NaOH溶液和Ca(HCO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
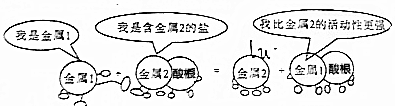
| A. | 此反应不可能是复分解反应 | |
| B. | 若金属1是锌,金属2可能是银 | |
| C. | 还原性:金属1>金属2 | |
| D. | 若金属2为铜,则反应过程中生成2mol金属2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g) CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
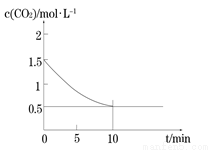
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时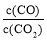 增大的是_________(填序号)。
增大的是_________(填序号)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入CH4的电极为负极 | |
| B. | 负极发生氧化反应 | |
| C. | 该电池使用一段时间后无需补充KOH | |
| D. | 燃料电池工作时,溶液中的OH-向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com