
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜作负极 | |
| C. | 电子由外导线从锌流向铜,进入硫酸溶液后被H+得到而释放出H2 | |
| D. | 铜锌原电池工作时,若电路中通过0.4 mole-,锌片质量将减少13g |
分析 A.构成原电池正负极的材料不一定是两种金属,可能是金属和非金属;
B.易失电子的金属作负极;
C.电子不能通过溶液;
D.根据锌和转移电子之间的关系式计算;
解答 解:A.构成原电池正负极的材料不一定是两种金属,可能是金属和非金属,如:锌、石墨、稀硫酸原电池,故A错误;
B.锌、铜和硫酸铜溶液构成的原电池中,锌易失电子作负极,铜作正极,故B错误;
C.电子由负极流向正极,但不能通过溶液,故C错误;
D.铜锌原电池放电时,负极上电极反应式为Zn-2e-=Zn2+,若电路中通过0.4 mole-,根据锌和转移电子之间的关系式,当有0.2×65=13g锌被溶解,故D正确;
故选D.
点评 本题考查了原电池原理,根据原电池正负极上反应类型、电子的流动方向与转移电子之间的关系式进行解答,难度不大;


科目:高中化学 来源: 题型:解答题
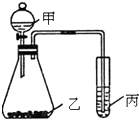 按要求完成下列各题:
按要求完成下列各题: .H2O的电子式为
.H2O的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
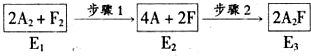
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入N2 | B. | 扩大容器容积 | C. | 移去部分NH3 | D. | 降低体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水、酒精和水 | B. | 四氯化碳和水、苯和液溴 | ||
| C. | 硝基苯和水、乙酸和水 | D. | 苯和水、己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )| A. | NaNO2在水中的溶解性大于NH4NO2 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI、淀粉和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2 转移6 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com