
| A. | CH2Cl2不存在同分异构体是甲烷正四面体结构的理由之一 | |
| B. | 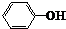 和 和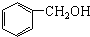 互为同系物 互为同系物 | |
| C. |  的系统命名的名称是1,2-二溴-2-环己烯 的系统命名的名称是1,2-二溴-2-环己烯 | |
| D. | 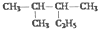 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
分析 A.如果甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合;
B.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.注意同系物中的“结构相似”是指物质种类相同,若含有官能团,官能团的种类与数目相同;
C.将溴原子看做侧链,从脂环上的官能团碳碳双键开始对环上的碳原子进行编号,由于双键上端的碳原子离支链溴原子更近,故双键上端的碳原子为1号碳原子,按顺时针对环上的碳原子进行编号,从而命名;
D.最长的链含5个碳为戊烷,2、3号碳上各有1个甲基.
解答 解:A.甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合,故A正确;
B. 和
和 的官能团不同,不是同系物,故B错误;
的官能团不同,不是同系物,故B错误;
C.将溴原子看做侧链,从脂环上的官能团碳碳双键开始对环上的碳原子进行编号,由于碳碳双键上端的碳原子离支链溴原子更近,故碳碳双键上端的碳原子为1号碳原子,按顺时针对环上的碳原子进行编号,从而2个溴原子,一个在1号碳原子上,一个在6号碳原子上,故此化合物的名称为:1,6-二溴-1-环己烯,故C错误;
D.最长的链含5个碳为戊烷,2、3号碳上各有1个甲基,名称为2,3-二甲基戊烷,故D错误;
故选A.
点评 本题考查较综合,涉及有机物命名、同系物、有机物结构等,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,解题关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
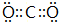 ,E的电子式
,E的电子式 ,其中E含有非极性共价键(填“离子键”、“极性共价键”或“非极性共价键”)
,其中E含有非极性共价键(填“离子键”、“极性共价键”或“非极性共价键”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小;则在卤素单质中碘的熔点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20.7% | B. | 22% | C. | 1.3% | D. | 7.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gNH4+含有质子的数目为10NA | |
| B. | 1molNa2O2与足量CO2反应时,转移电子的数目为2NA | |
| C. | 标准状况下,体积均为22.4L的O2、HCl、H2O含有的分子数目均为NA | |
| D. | 质量为16g的O2和O3的混合气体中所含氧原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| C. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| D. | 为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com