
| A. | ②③④⑧⑨ | B. | ⑤⑦⑧⑨⑩ | C. | ②③④⑤⑦ | D. | ①⑥⑧ |
分析 有些试剂长期存放会因分解或转化成其他物质而变质,甚至出现不良后果,如石灰水、氢硫酸、FeSO4溶液会因为与空气中CO2或O2反应而变质;氯水见光或受热易分解;银氨溶液因转化成易爆的雷酸银而不能长期存放,据此进行判断.
解答 解:①溴水,可以长期保存,不必现用现配,故①错误;
②银氨溶液,银氨溶液因转化成易爆的雷酸银而不能长期存放,必须现用现配,故②正确;
③石灰水,与空气中CO2反应而变质,需要现用现配,故③正确;
④氯水,氯水见光或受热易分解,必须现用现配,故④正确;
⑤硫化氢,与空气中O2反应而变质,必须现用现配,故⑤正确;
⑥NaOH溶液,密封保存即可,不必现用现配,故⑥错误;
⑦FeSO4溶液,与空气中O2反应而变质,必须现用现配,故⑦正确;
⑧FeCl3溶液,不必现用现配,故⑧错误;
⑨CuSO4溶液,性质稳定,不需要现用现配,故⑨错误;
⑩醋酸,性质稳定,不需要现用现配,故⑩错误;
故选C.
点评 本题考查了试剂的存放,题目难度不大,涉及的内容较多,可以根据试剂的性质进行分析,充分考查了学生对所学知识的掌握情况.


科目:高中化学 来源: 题型:选择题
| A. | ⑤②④①③ | B. | ⑤④②①③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质“溶液”是一种胶体,向该分散系中加入少量的盐(如硫酸铵)能促进蛋白质的溶解 | |
| B. | 饱和(NH4)2SO4溶液能使蛋白质变性 | |
| C. | 用半透膜可除去蛋白质溶液中的NaCl | |
| D. | 用灼烧的方法检验是毛线还是棉线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
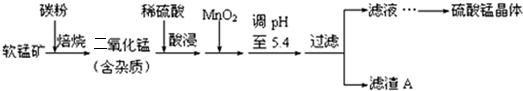
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4 和CH2Cl2 | B. | H3O+ 和NH4+ | C. | CaO2 和 CaF2 | D. | Ba(0H)2 和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁与足量的氢氧化钠溶液反应:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 氧化铝和过量的烧碱溶液反应:Al2O3+3OH-═2AlO2-+H2O | |
| C. | 氯化铝溶液与少量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ | |
| D. | 向碳酸钙中滴加醋酸溶液:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③④ | C. | ①③④⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量样品于试管中,滴加适量的1mol?L-1H2SO4溶液,加热溶解,得到A溶液 | |
| 步骤2: | 若高锰酸钾溶液紫红色褪去,则样品中含+2价的铁元素 |
| 步骤3: | 若溶液变红色,则样品中含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com