
| A. | 简单氢化物的沸点:X<W | B. | 元素的非金属性:W<X | ||
| C. | Y、Z的氧化物均含有离子键 | D. | Y、W形成的化合物的水溶液显碱性 |
分析 短周期主族元素中X、Y、Z、W的原子序数依次增大,主族元素中X的原子半径仅大于氢,X为F,Z原子的最外层电子数与最内层电子数相同,Z为Mg,W的最低化合价的绝对值与Z的最高化合价相同,若Z的最高价为+2,则W为S,结合原子序数可知,Y只能为Na,以此来解答.
解答 解:由上述分析可知,X为F,Y为Na,Z为Mg,W为S,
A.非金属性越强,对应氢化物越稳定,则简单氢化物的沸点:X>W,故A错误;
B.周期表中F的非金属性最强,则元素的非金属性:W<X,故B正确;
C.Y、Z的氧化物均含金属离子与阴离子形成的离子键,故C正确;
D.Y、W形成的化合物为Na2S,其水溶液水解显碱性,故D正确;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的甲醇所含的氢原子数等于2NA | |
| B. | 常温常压下,Na2O2 与 H2O 反应生成 1mol O2 时,转移电子数是 2NA | |
| C. | 25℃时,Kap(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-6 NA | |
| D. | 1L 1 mol/L AlCl3溶液中含有的Al3+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
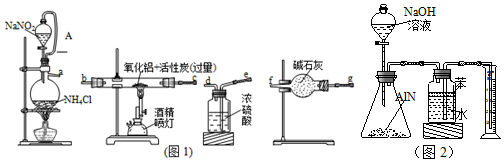
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84消毒液”与含盐酸的沽厕灵混合使用可增强消毒效果 | |
| B. | 《淮南万毕术》所述“白青得铁化为铜”涉及置换反应 | |
| C. | 使用活性炭口罩可减少雾霾对人体的毒害,其原理是活性炭具有杀菌消毒作用 | |
| D. | 用氢氟酸刻蚀玻璃制备工艺品,利用了氢氟酸的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
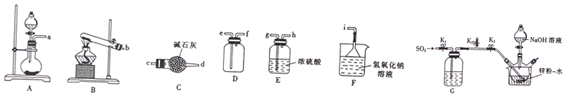
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
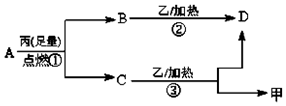 常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )
常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )| A. | X、Y、Z三种元素可能组成是离子化合物 | |
| B. | 反应②为化合反应,反应③为置换反应 | |
| C. | 常温常压下,Z的氢化物熔点为同族最高 | |
| D. | 原子半径:Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 向碳酸钠溶液中逐滴加入等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用铝热反应焊接铁轨 | B. | 用稀盐酸除去水垢 | ||
| C. | 用胃舒平(氢氧化铝)治疗胃酸过多 | D. | 工业上煅烧石灰石制生石灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com