
某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
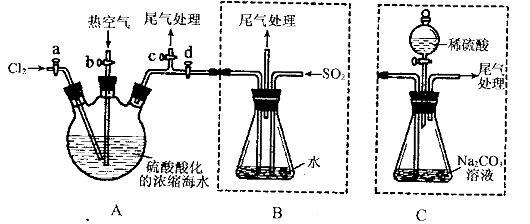
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2:
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中常用来制备氯气的化学方程式为__________________________;
(2)步骤②中鼓入热空气的作用为_____________________________;
(3)步骤B中发生的主要反应的离子方程式为______________________________。
(4)此实验中尾气可用 (填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
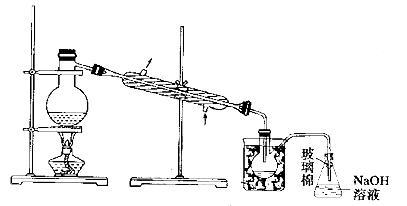
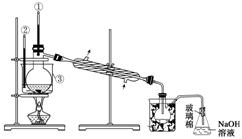
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(7)与B装置相比,采用C装置的优点为____________。
【知识点】化学实验 元素化合物D5 J1 J4 J2
【答案解析】(1)MnO2+4HCl(浓) 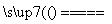 MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)使A中生成的Br2 随空气流进入B中(2分)
(3)Br2+SO2+2H2O=4H++2Br-+SO (2分)
(2分)
(4)c(2分)
(5)①③必画,②不做要求(③水溶液液面与烧杯内液体相对高度可不作要求)(2分)
(6)3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑(2分)
(7)操作简单、污染小(1分,只要答出1点即可得分)
解析:⑴实验室中常用来制备氯气往往用二氧化锰氧化浓盐酸:MnO2+4HCl(浓) 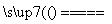 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑵鼓入热空气的作用为将A中生成的Br2 吹入B中
⑶步骤B中发生的主要反应是溴被二氧化硫还原为Br-,反应是Br2+SO2+2H2O=4H++2Br-+SO
⑷尾气中含可能没有反应完的二氧化硫或氢溴酸,可用氢氧化钠溶液吸收
⑸蒸馏时需要温度计控制温度,加碎瓷片防止爆沸,为了使液体受热均匀,可采取水浴加热。
⑹溴与碳酸钠溶液反应生成NaBrO3,则根据氧化还原反应规律知还生成NaBr,即3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
⑺仔细观察B、C装置知与B装置相比,采用C装置的优点为产生的污染少(减少二氧化硫的排放),操作简单。
【思路点拨】熟练掌握溴、二氧化硫的性质是关键;运用比较的方法分析装置特点与差异。


科目:高中化学 来源: 题型:
丙烯酸乙酯(化合物Ⅳ)是制备塑料、树脂等高聚物的重要中间体,可由下面路线合成:
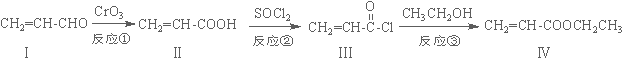 (1)化合物Ⅳ的分子式为 ,1 mol化合物Ⅳ完全燃烧消耗O2为 mol。
(1)化合物Ⅳ的分子式为 ,1 mol化合物Ⅳ完全燃烧消耗O2为 mol。
(2)化合物Ⅱ能使溴水褪色,其反应方程式为 。
(3)反应②属于 反应,化合物Ⅰ可以由化合物Ⅴ(分子式为C3H6O)催化氧化得到,则化合物Ⅴ→Ⅰ的反应方程式为 。
(4)化合物Ⅵ是化合物Ⅳ的同分异构体,Ⅵ含有碳碳双键并能与NaHCO3溶液反应放出气体,其核磁共振氢谱峰面积之比为1:1:6,则化合物Ⅵ的结构简式为 。
(5)一定条件下,化合物  也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 。
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,下列说法错误的是( )
| 电离能/kJ·mol-1 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11 |
A.元素X的常见化合价是+1价
 B.元素Y是第ⅢA族元素
B.元素Y是第ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,则它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Fenton法常用于处理含难降解有机物的工业废水,通常 是在调节好pH和
是在调节好pH和
Fe2+浓度的 废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-
废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-
CP,探究有关因素对该降解反应速率的影响.
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下 表),设计如
表),设计如
下对比实验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 |
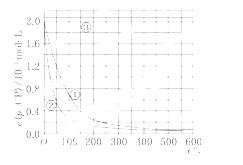
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图.
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:v(p-CP)=________mol/(L·s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________.
(4)实验③得出的结论是:pH等于10时,________.
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:_______________________
_______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
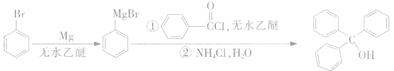
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:
实验步骤如下:
①如图1所示,在三颈烧瓶中加入1.5 g镁屑,在滴液漏斗中加入6.7 mL溴苯和无水乙醚,先加人1/3混合液于烧瓶中,待镁屑表面有气泡产生时,开始搅拌,并逐滴加入余下的混合液,使反应液保持微沸状态,至反应完全。
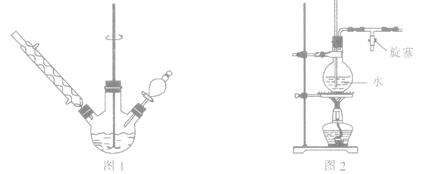
②继续加入3.7 g苯甲酰氯和无水乙醚,水浴回流l h 后,在冷水浴下慢慢滴加氯化铵的饱和溶液30.0 mL。
③将三颈烧瓶内的物质水浴加热蒸去乙醚,然后加入30.0 mL水进行水蒸气蒸馏(图2用作水蒸气发生装置),直至无油状物蒸出。
④冷却抽滤,将固体用80.0%的乙醇溶液重结晶,最终得到产品。
(1)步骤①中“逐滴加入余下的混合液”是为了防止 。
(2)若水蒸气蒸馏装置中出现堵塞现象,则图2玻璃管中水位会突然升高,此时应 ,待故障排除后再进行蒸馏。
(3)抽滤用到的主要仪器有气泵、 ,抽滤优于普通过滤的显著特点是 。
(4)步骤④中用80.0%的乙醇溶液重结晶的目的是 。
(5)用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是 ( )
A.甲醇 B.天然气 C.液化石油气 D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的说法不正确的是 ( )
A.除0族元素外,非金属元素全部都是主族元素
B.第3周期非金属元素含氧酸的酸性从左到右依次增强
C.同周期第ⅡA族与第ⅢA族元素的原子序数之差可能为25
D.同族上下相邻两种元素的原子序数之差可能为32
查看答案和解析>>
科目:高中化学 来源: 题型:
对于碳骨架如下的4种烃,下列描述不正确的是
( )

A.a和d是同分异构体
B.b和c是同系物
C.a和d都能发生加成反应
D.b和c、d都能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com