
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
分析 ①裂解汽油主要成分为C6~C9烃类;
②石油裂解能得到乙烯,乙烯可发生加聚反应;
③天然气的主要成分为甲烷,燃烧生成二氧化碳和水;
④四氯化碳的密度比水大,环己烯含有碳碳双键,环己烷与高锰酸钾不反应,密度比水小;
⑤石油产品含有烷烃;
⑥苯存在同分异构体;
⑦煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇;
⑧石油中含有1~50个碳原子的烷烃及环烷烃.
解答 解:①裂解汽油主要成分为C6~C9烃类,为混合物,故错误;
②石油裂解可以得到含有乙烯、丙烯、丁二烯等不饱和烃外,还含有甲烷、乙烷、氢气等气体,乙烯气体发生加聚反应得到聚乙烯,故正确;
③天然气的主要成分为甲烷,燃烧生成二氧化碳和水,为清洁燃料,故正确;
④四氯化碳的密度比水大,环己烯含有碳碳双键,环己烷与高锰酸钾不反应,密度比水小,可用高锰酸钾溶液鉴别,故正确;
⑤石油产品含有烷烃,不能发生加聚反应,故错误;
⑥苯存在同分异构体,故错误;
⑦煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化,故正确;
⑧石油中含有1~50个碳原子的烷烃及环烷烃,故正确.
故选D.
点评 本题考查较为综合,涉及多方面知识的考查,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | a、c两种元素只能组成化学式为ca3的化合物 | |
| B. | b、c、d分别与a形成的简单化合物,沸点由高到低依次为:d>c>b | |
| C. | 原子半径由大到小的顺序是 e>f>c>b>a | |
| D. | 元素的非金属性由强到弱的顺序是 d>c>f>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子的还原性:W>Z | B. | 单质的沸点:W>Y | ||
| C. | 最高价氧化物的水化物的酸性:Y<Z | D. | 四种元素一定都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
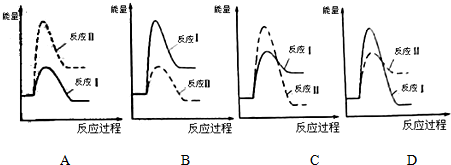
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
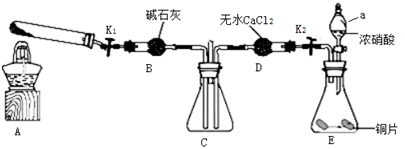
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
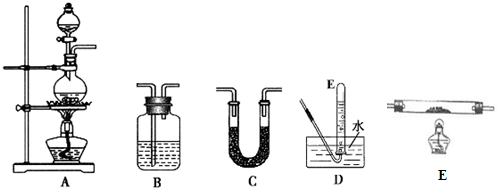
| 选用的仪器 | 加入的试剂 |
| A | 甲酸、浓硫酸 |
| D | -- |
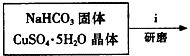
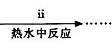
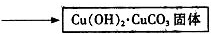
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | \ |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com