
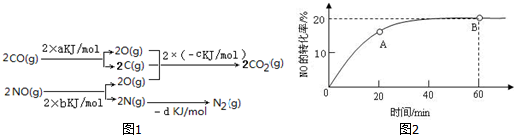
���� ��1��2NO��g��+2CO��g���TN2��g��+2CO2��g����Ӧ�ȵ��ڷ�Ӧ��ļ���֮�ͼ�ȥ������ļ���֮�ͣ��ݴ˽��м��㣻
��2���ٸ��¶��£���ͼ���֪�ﵽƽ��ʱNOת����Ϊ20%����NOת�������ʵ���Ϊ��3mol��20%=0.6mol�����ݷ�Ӧ2NO��g��+2CO��g���TN2��g��+2CO2��g����֪��COת����0.6mol����Ӧ���ɵ�����������̼�ֱ�Ϊ0.3mol��0.6mol����ƽ��ʱ������Ũ�ȷֱ�Ϊ��c��NO��=$\frac{3mol-0.6mol}{1L}$=2.4mol/L��c��CO��=$\frac{1mol-0.6mol}{1L}$=0.4mol/L��c��N2��=$\frac{0.3mol}{1L}$=0.3mol/L��c��CO2��=$\frac{0.6mol}{1L}$=0.6mol/L��Ȼ����ݻ�ѧƽ�ⳣ������ʽ���㼴�ɣ�ƽ��ʱCO��ת����=$\frac{��Ӧת�������ʵ���}{��Ӧǰ�����ʵ���}$��100%��
�ڸ������ŷ�Ӧʱ�з�Ӧ��Ũ�ȼ�С����Ӧ���ʼ�С�ж�A����淴Ӧ������V����CO����B����淴Ӧ����V����NO����С��
�۴�ƽ����������ݻ�����һ�����൱�ڼ�С��ѹǿ��ƽ��������������ƶ��������淽���ƶ����ݴ˽��з�����
��� �⣺��1��2NO��g��+2CO��g���TN2��g��+2CO2��g����Ӧ�ȵ��ڷ�Ӧ��ļ���֮�ͼ�ȥ������ļ���֮�ͣ�����ͼ1��֪�÷�Ӧ���ʱ�Ϊ����H=��2a+2b-2c-d0kJ/mol��
�ʴ�Ϊ��2a+2b-2c-d��
��2���ٸ��¶��£���ͼ���֪�ﵽƽ��ʱNOת����Ϊ20%����NOת�������ʵ���Ϊ��3mol��20%=0.6mol�����ݷ�Ӧ2NO��g��+2CO��g���TN2��g��+2CO2��g����֪��COת����0.6mol����Ӧ���ɵ�����������̼�ֱ�Ϊ0.3mol��0.6mol����ƽ��ʱ������Ũ�ȷֱ�Ϊ��c��NO��=$\frac{3mol-0.6mol}{1L}$=2.4mol/L��c��CO��=$\frac{1mol-0.6mol}{1L}$=0.4mol/L��c��N2��=$\frac{0.3mol}{1L}$=0.3mol/L��c��CO2��=$\frac{0.6mol}{1L}$=0.6mol/L��
�����ݴ��뻯ѧƽ�ⳣ������ʽ�ɵã�K=$\frac{0.3��0��{6}^{2}}{2��{4}^{2}��0��{4}^{2}}$=$\frac{15}{128}$��
ƽ��ʱCO��ת����Ϊ��$\frac{0.6mol}{1mol}$��100%=60%��
�ʴ�Ϊ��$\frac{15}{128}$��60%��
���������ŷ�Ӧʱ�з�Ӧ��Ũ�ȼ�С�����ʼ�С����A����淴Ӧ������V����CO��С��B����淴Ӧ����V����NO����
�ʴ�Ϊ������
�۴�ƽ����������ݻ�����һ�����൱�ڼ�С��ѹǿ��ƽ��������������ƶ��������淽���ƶ���
A�����ݷ�����֪��ƽ�����������ƶ�����A����
B��ƽ�����������ƶ�����CO�������������B��ȷ��
C��ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ƽ�ⳣ�����䣬��C����
D����������������һ����̼�����ʵ�������Ҫ����Ũ�Ȼ��С����D����
�ʴ�Ϊ��B��
���� ���⿼���˻�ѧƽ��ļ��㡢��Ӧ�ȼ��㣬��Ŀ�Ѷ��еȣ���ȷ��ѧƽ�⼰��Ӱ��Ϊ���ؼ���ע�����ջ�ѧ�����ѡ��γ��е������仯���ʱ�֮��Ĺ�ϵ������������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
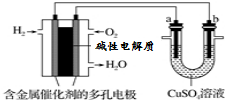
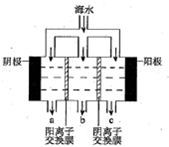
| A�� | ��װ�����ڵ��ͭʱ�����һ��ʱ�䣬����ͭ��Һ��Ũ�Ȳ��� | |
| B�� | ��aΪ��ͭ��bΪ��ͭ����װ�ÿ����ڴ�ͭ�ĵ�⾫�� | |
| C�� | ȼ�ϵ����������ӦΪO2+4e-+2H2O=4OH- | |
| D�� | ���Ӿ���������b�缫 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
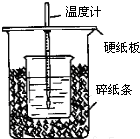 ��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
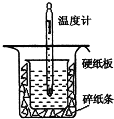 �к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�飮ȡ0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺
�к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�飮ȡ0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �²t2-t1���� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
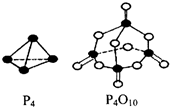 ���������������ж�����ȼ�գ�
���������������ж�����ȼ�գ�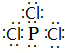 ��PCl3ˮ��õ��������ᣨH3PO3����һ�ֶ�Ԫ���ᣬд��������������NaOH��Ӧ�����ӷ���ʽH3PO3 +2OH-=HPO32-+2H2O��ij�¶��£�0.1mol•L-1��������Һc��H+��=2.5��10-2mol•L-1����OH-֮����������Ũ���ɴ�С˳����c��H+����c��H2PO3-����c��HPO32-����
��PCl3ˮ��õ��������ᣨH3PO3����һ�ֶ�Ԫ���ᣬд��������������NaOH��Ӧ�����ӷ���ʽH3PO3 +2OH-=HPO32-+2H2O��ij�¶��£�0.1mol•L-1��������Һc��H+��=2.5��10-2mol•L-1����OH-֮����������Ũ���ɴ�С˳����c��H+����c��H2PO3-����c��HPO32-�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
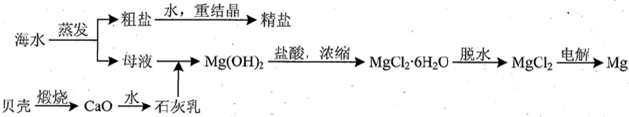
 ��ˮ����Ҫ���ӵĺ������£�
��ˮ����Ҫ���ӵĺ������£�| �ɷ� | ����/��mg/L�� | �ɷ� | ����/��mg/L�� |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHSO4�TNa++HSO4- | B�� | NaHCO3�TNa++H++CO32- | ||
| C�� | H2CO3?2H++CO32- | D�� | A12��SO4��3�T2A13++3SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
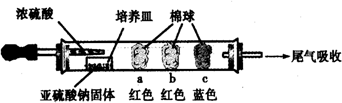
| ���� | �����ϵμӵ��Լ� | ʵ������ | ���ͺͽ��� |
| a | Ʒ����Һ | �����ף��Ⱥ��ָֻ���ɫ | SO2����Ư���ԣ���Ϊ��ʱ��Ư�� |
| b | ����̪��NaOH��Һ | �����Ϊ��ɫ | ���ӷ���ʽ��2OH��+SO2 =SO32��+H2O��OH��+SO2=HSO3�� |
| c | �����۵ĵ�ˮ | �����Ϊ��ɫ | ��������л�ԭ�� ��ѡ������ԡ���ԭ�ԡ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ����������������ԭ�������������� | |
| B�� | ��ԭ�ӵ��Ӳ�������ԭ�ӵ��Ӳ����� | |
| C�� | 1mol�״������û����ɵ�������1mol�Ҵ������û����ɵ������� | |
| D�� | �����£�������ˮ��Ӧ�������������Ҳ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com