
恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆反应:H2(g)+I2(g)⇌2HI(g)△H=-14.9kJ/mol,实验时有关数据如表:
| 容器编号 | 起始浓度mol/L | 平衡时的浓度mol/L | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
下列判断正确的( )
A.平衡时,乙中颜色更深,a>0.008
B.平衡时,放出的热量:Q1=1/2Q2=0.149kJ
C.该温度下,该反应的平衡常数K=4
D.平衡后,向甲中再充入0.004mol HI气体,再次达到平衡时HI的百分含量不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH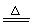 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。请完成FeO42-与水反应的方程式:4FeO42-+10H2O  4Fe(OH)3+8OH-+( )
4Fe(OH)3+8OH-+( )
(3)K2FeO4在处理水的过程中能消毒杀菌是因为① ,
它能净水的原因是② 。
(4) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
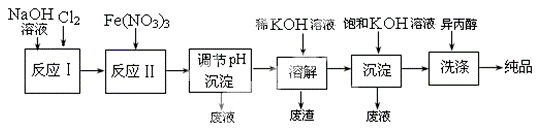
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的Cl-浓度与100 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是
A.200 mL 1 mol·L-1 KCl溶液 B.50 mL 2 mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 NaCl溶液 D.50mL 1 mol ·L-1 AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A. NO2通入FeSO4溶液中 B. CO2通入CaCl2溶液中
C. NH3通入AlCl3溶液中 D. SO2通入已酸化的Ba( NO3 )2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:
MnO4-+C2O42-+H+-→CO2↑+Mn2++ ,
关于此反应的叙述正确的是 ( )
A.该反应的氧化剂是C2O42-
B.该反应右边方框内的产物是OH-
C.该反应中生成1molCO2电子转移数总是5NA
D.配平该反应式后,H+的系数是16
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
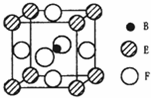 (5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是一种航天器能量储存系统原理示意图。下列说法正确的是:
A.该系统中只存在3种形式的能量转化
B.装置Y中电能转化为化学能
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A.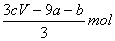 B.(a+3b)mol C.
B.(a+3b)mol C.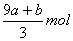 D.(cV-3a-9b)mol
D.(cV-3a-9b)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com