
分析 (1)已知①4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905.48kJ•mol-l
②N2(g)+O2(g)=2NO(g);△H=180.50kJ•mol-l
根据盖斯定律,①+②×5得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)
(2)①已知总反应的快慢由慢的一步决定,
②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,而正反应是放热反应,所以升高温度,平衡常数减小;
(3)增加排气管长度,增大了相当于增大了固体的接触面积,加快了化学反应速率;
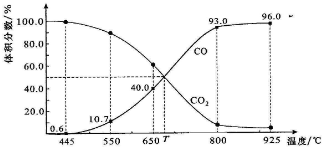
(4)由图可知,800℃时,反应达平衡后CO的体积分数为93%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2.
解答 解:(1)已知①4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905.48kJ•mol-l
②N2(g)+O2(g)=2NO(g);△H=180.50kJ•mol-l
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①+②×5得到:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1807.98kJ/mol,
故答案为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1807.98kJ/mol.
(2)①第二步:N2O2(g)+O2(g)═2NO2(g) (慢),主要是由第二步决定反应速率,
故答案为:第二步;
②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{2})•c({O}_{2})}$=$\frac{{k}_{1正}•{k}_{2正}}{{k}_{1逆}•{k}_{2逆}}$,而正反应是放热反应,所以升高温度,平衡常数减小,
故答案为:$\frac{{k}_{1正}•{k}_{2正}}{{k}_{1逆}•{k}_{2逆}}$;减小;
(3)增加排气管长度,增大了相当于增大了固体的接触面积,加快了化学反应速率,
故答案为:能;增加排气管长度,相当于增大了NOx与活性炭涂层的接触面积,能加快化学反应速率;延长了二者的接触时间,使反应更充分;
(4)由图可知,800℃时,反应达平衡后CO的体积分数为93%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=93%,解得x=0.87mol,则CO2的转化率为$\frac{0.87}{1}$×100%=86.9%,
故答案为:86.9%;
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2,
故答案为:2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2.
点评 本题考查了盖斯定律的应用、化学平衡的影响因素,电解质溶液和电极反应式的书写,题目综合性较强,难度中等,侧重于考查学生的分析能力、以及对基础知识的综合应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COOK(固体) | B. | CH3COOH | C. | KCl(固体) | D. | KOH(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉-KI试液 | 先变蓝后褪色 | Cl2具有氧化性和漂白性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
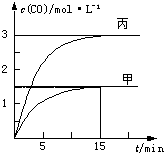 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )| 容 器 | 甲 | 乙 | 丙 |
| 容 积 | 0.5L | 0.5L | V |
| 温 度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.2mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5(mol•L-1) | |
| D. | 乙容器中,若平衡时n(H2O)=0.4mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | $\frac{1}{3}$ | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com