
| A.此陨石是一种纯度较高的硅酸盐矿石 |
| B.此陨石具有耐酸碱的特性 |
| C.陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D.橄榄石中Fe为+2价 |
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:不详 题型:填空题

| | ① | ② | ③ | ④ |
| 溶液中的金属离子 | | Fe2+ | | |
| 残留固体成分 | Fe、Pt | | Pt | Pt |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
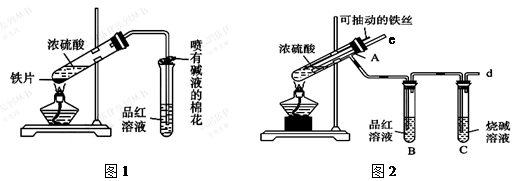
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 | 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,____________________ __________________________。 | __________________ __________________ _________________。 | 乙同学的观点____________ (填“正确”或“错误”)。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。 还原成Mn2+。
还原成Mn2+。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
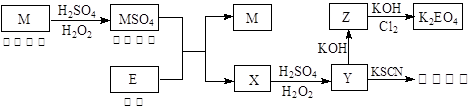
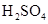 和
和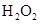 混合液的离子方程式: 。
混合液的离子方程式: 。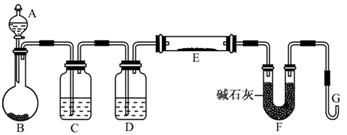
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:2 | B.2:1 | C.1:1 | D.4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com